Após as últimas semanas de isolamento que vivemos, prepara-se agora gradualmente o regresso à normalidade. Uma normalidade que será ainda bastante diferente daquilo que conhecíamos, pedindo-se, nesta fase, que se aprenda a conviver com o vírus.
Ora bem, tendo em conta que o vírus veio para ficar e que vamos ter efetivamente de viver com ele, nunca foi tão importante cuidar da sua alimentação e estilo de vida para que o seu sistema imunitário tenha todas as ferramentas necessárias para combater este vírus de forma eficaz, caso haja um possível contágio.
Em primeiro lugar, é importante perceber, de forma muito simplista, como funciona este vírus. O SARS-CoV-2 tem a habilidade de estimular uma libertação descontrolada de citocinas pró-inflamatórias, levando a um efeito de tempestade de citocinas, causando lesão tecidual e danos graves no epitélio respiratório.
Assim sendo, parece que a palavra a reter é inflamação, sendo esta a causa dos danos graves e mesmo da morte. Extrapolando um pouco o raciocínio, quem sofre contágio com um status inflamatório mais elevado, está, à partida, em maior risco de sofrer danos mais severos. E é isso que se tem observado! As pessoas com comorbilidades, nomeadamente obesidade, doenças autoimunes, hipertensão arterial, cancros, são considerados grupos de risco para esta pandemia e possuem, também todos eles, estados inflamatórios mais acentuados.
Portanto, a chave parece ser trabalharmos nos nossos estilos de vida, para melhorarmos o nosso status inflamatório e assim diminuirmos o risco de sofrer de uma doença crónica não transmissível. Ao mesmo tempo, é importante fornecermos as ferramentas para que o nosso sistema imunitário seja capaz de uma resposta adequada em caso de contágio. Como é que isso se faz?
Em primeiro lugar, e isto é, de longe, o ponto mais importante de todo este artigo. O grande segredo, o grande milagre, a pílula mágica para melhorar a sua alimentação do dia para noite é só um, coma COMIDA! Mas comida de verdade, daquela que não tem ingredientes, nem rótulos, nem marketing ou alegações de saúde. Falo de carne, peixe, marisco, ovos, vegetais, fruta, oleaginosas. Simples assim!
Comer comida de verdade deixa-o num ponto muito mais à frente que a grande maioria das outras pessoas no que toca à capacidade de resposta do seu sistema imunitário. Isto porque, quando comemos alimentos de verdade, o seu organismo recebe uma panóplia variada de vitaminas, minerais, antioxidantes, fitoquímicos, polifenóis, tudo aquilo que o organismo necessita para funcionar de forma correta. No entanto, e tendo em conta as necessidades e os requisitos específicos de cada indivíduo, é de extrema importância a individualização, razão pela qual é essencial ser acompanhado por um profissional da área da nutrição.
Outro ponto de extrema importância e que está diretamente relacionado com o anterior: a nossa imunidade começa no intestino e, portanto, ter um microbiota diversificado e saudável e uma mucosa intestinal íntegra é essencial. Sabemos que o microbiota é um grande responsável pelo status inflamatório do organismo, sendo, portanto, de máxima importância cuidarmos das nossas bactérias intestinais.
Para tal, é essencial o consumo adequado de fibra, solúvel e insolúvel. E portanto, voltamos a falar de frutas e vegetais! Estas deverão estar presentes em grandes quantidades na dieta de todos nós. Para além da fibra, o consumo de alimentos fermentados deve ser incentivado, nomeadamente vegetais fermentados (como por exemplo chucrute), kombucha e kefir, como forma de modular o microbioma e reparar a mucosa intestinal.
Tendo em conta que o vírus SARS CoV-2 é relativamente recente, ainda não são muitos os estudos que nos mostrem quais os compostos ativos que têm uma ação direta no vírus. No entanto, conhecendo o mecanismo de atuação do SARS CoV-2, podemos aferir ou deduzir quais os compostos que vão atuar na diminuição da capacidade do vírus infetar as nossas células, diminuir a replicação viral e dar suporte ao nosso sistema imunológico.
Assim sendo, existem alguns compostos ativos, vitaminas e minerais que atuam nestas diferentes vias. Alguns destes compostos podem ser obtidos através de suplementação específica e outros através da alimentação. No entanto, é preciso relembrar que a suplementação deve ser prescrita por um profissional de saúde, tendo em conta as necessidades e o historial clínico de cada um. Não é adequado tomar suplementos sem haver um motivo clínico que o justifique.
Naturalmente que nenhum destes suplementos impede o contágio e, neste sentido, apenas as medidas de higiene adequadas e o distanciamento social são eficazes. Não obstante, em caso de contágio, o nosso sistema imunitário tem de ser o mais eficaz a combater o vírus e a diminuir os sintomas associados.
Os seguintes nutrientes e compostos ativos de forma isolada parecem ser grandes aliados:
Vitamina A: desempenha um papel importante na função imune, regulando as respostas imunes celulares e humorais (Huang et al., 2018). A nível alimentar pode ser encontrada nas vísceras dos animais, como fígado, e nas gemas dos ovos. A suplementação só deve ser considerada caso se confirmem défices a nível sérico.
Vitamina C: contribui para a defesa imunológica, melhorando a quimiotaxia e fagocitose (Beveridge, Wintergerst, Maggini and Hornig, 2008). A suplementação com vitamina C pode não ser necessária caso a ingestão alimentar seja adequada. Para isso, é necessário consumir frutas e vegetais ricos em vitamina C ao longo do dia, nomeadamente kiwis, citrinos, morangos, pimentos, agrião e salsa.
Vitamina D: participa na modulação da resposta tanto do sistema imune inato como adaptativo. Parece haver uma relação entre o status de vitamina D do indivíduo e a resposta antiviral contra infeções respiratórias (Jayawardena et al., 2020). A suplementação só deve acontecer caso existam défices, mas esta é muitas vezes necessária, especialmente durante os meses de Inverno.
Zinco: participa no funcionamento do sistema imunitário e diminui a replicação viral, reduzindo a gravidade das infeções. A deficiência de zinco está assim associada a uma maior susceptibilidade a infeções virais (Read, Obeid, Ahlenstiel and Ahlenstiel, 2019). No entanto, e uma vez mais, a suplementação só deve ser feita caso se verifiquem défices comprovados deste mineral. Na alimentação, pode ser encontrado nas ostras, na carne vermelha e nas sementes de girassol.
Selénio: possui propriedades anti-inflamatórias e um efeito antioxidante. A deficiência de selénio está associada com uma função imune mais débil (Rayman, 2012). O consumo diário de castanhas do Brasil pode auxiliar na obtenção de valores adequados de selénio no organismo.
Melatonina: tem um efeito antioxidante e anti-inflamatório e promove uma diminuição nas citocinas inflamatórias em circulação (Zhang et al., 2020). A suplementação pode ser necessária, dependendo das necessidades do indivíduo.
Estas são algumas das estratégias a aplicar em termos alimentares. No entanto é importante (re)lembrar que as mudanças a efetuar devem ser de estilo de vida, onde se devem incluir hábitos de exercício físico regular, adequação de padrões de sono, gestão de stress e diminuição da exposição a toxinas. Todas estas alterações contribuirão para a diminuição da inflamação e para melhoria da função do sistema imunitário, tão importante para os tempos actuais e para a melhoria da nossa qualidade de vida.
Andreia Luís de Castro
Referências:
Beveridge, S., Wintergerst, E., Maggini, S. and Hornig, D., 2008. Immune-enhancing role of vitamin C and zinc and effect on clinical conditions. Proceedings of the Nutrition Society, 67(OCE1).
Huang, Z., Liu, Y., Qi, G., Brand, D. and Zheng, S., 2018. Role of Vitamin A in the Immune System. Journal of Clinical Medicine, 7(9), p.258.
Jayawardena, R., Sooriyaarachchi, P., Chourdakis, M., Jeewandara, C. and Ranasinghe, P., 2020. Enhancing immunity in viral infections, with special emphasis on COVID-19: A review. Diabetes & Metabolic Syndrome: Clinical Research & Reviews, 14(4), pp.367-382.
Rayman, M., 2012. Selenium and human health. The Lancet, 379(9822), pp.1256-1268.
Read, S., Obeid, S., Ahlenstiel, C. and Ahlenstiel, G., 2019. The Role of Zinc in Antiviral Immunity. Advances in Nutrition, 10(4), pp.696-710.
Zhang, R., Wang, X., Ni, L., Di, X., Ma, B., Niu, S., Liu, C. and Reiter, R., 2020. COVID-19: Melatonin as a potential adjuvant treatment. Life Sciences, 250, p.117583.
Este artigo é técnico e específico, se aquilo que pretende é apenas saber o que precisa fazer, pode ir directamente para a conclusão. Se, porventura, quiser educar-se um pouco mais sobre o potencial do exercício na sua saúde e imunidade, recomendo que vá buscar um café ou um chá e que leia o artigo completo.
Introdução
Uma das questões mais recorrentes nos últimos tempos em virtude do tema “Coronavírus” é se o exercício físico pode melhorar a função do sistema imunitário. Mas vamos recuar primeiro um pouco no tempo. A necessidade de se movimentar ou de fazer exercício para manter ou melhorar a saúde não é nova. O movimento sempre foi e sempre será uma necessidade essencial à condição humana. O problema actual é que no nosso estilo de vida moderno (altamente sedentário) a maior parte das pessoas esqueceu-se disso, deixou de alimentar a sua motricidade e pensa que consegue resolver os seus problemas de saúde com soluções rápidas ou temporárias de fitness.
Ou seja, se sabemos que o exercício tem a possibilidade de afectar todos os órgãos e sistemas do corpo humano, é natural (e desejável) que o sistema imunitário seja também regulado pelo nível de actividade física de cada indivíduo. A inactividade física em conjunto com a perda de massa muscular (e alimentação deficiente) irá facilitar a imunosenescência, a perda de função do sistema imunitário. Clinicamente, isto significa um maior risco de infecções, reactivações mais frequentes de vírus latentes, diminuição da eficácia da vacinação e aumento da prevalência de doenças auto-imunes e cancro1.
Portanto, temos por um lado o movimento ou a actividade física, que é transversal à evolução de qualquer homo sapiens e, por outro, temos o treino físico, que pode ser o catalisador para elevar os resultados da performance humana para outros patamares. A percepção geral de que a actividade física regula o sistema imunitário é correcta mas a ideia generalizada de que qualquer forma de exercício melhora o sistema imunitário é incorrecta. Simplesmente não podemos ignorar os princípios elementares da biologia humana e do ciclo de stress, recuperação e adaptação inerentes a cada indivíduo.
Contextualização da imunologia do exercício
Embora a imunologia do exercício seja considerada (relativamente) uma nova área de investigação científica, com 90% dos trabalhos publicados após 19902, alguns dos primeiros estudos foram publicados há mais de um século. Por exemplo, em 1902, Larrabee3 demonstrou que as alterações nas contagens diferenciais de glóbulos brancos nos corredores de maratona de Boston eram semelhantes às observadas em certas condições de doença, com uma “considerável leucocitose do tipo inflamatório”.
De acordo com a revisão efectuada por Nieman4, uma das maiores autoridades mundiais em imunologia do exercício, e que por acaso já correu mais de 50 maratonas, as descobertas científicas neste campo podem ser divididas em quatro períodos distintos. De 1900 a 1979, o foco era nas alterações agudas e na função das células imunitárias. De 1980 a 1989, vários estudos sugeriram que o esforço de intensidade elevada estava associado com uma disfunção imunitária transiente, com a elevação de biomarcadores inflamatórios e com um aumento do risco de infecções do trato respiratório superior. Durante o período de 1990 a 2009, foram adicionadas outras áreas complementares de estudo, incluindo o efeito interactivo da nutrição, os efeitos do exercício no envelhecimento do sistema imunitário e as influências nas citocinas inflamatórias. A partir de 2010, com os avanços na espectometria de massa e na tecnologia associada aos testes genéticos, começou-se a depositar maior atenção em áreas de estudo como a metabolómica, lipidómica, proteómica e microbioma, com o intuito de fornecer directrizes mais personalizadas ao nível da nutrição e exercício.
Portanto, já sabemos há muito tempo que o sistema imunitário é muito sensível ao exercício físico e, como tal, será a extensão e a intensidade do exercício, que vão reflectir o nível de stress fisiológico imposto ao sistema imunitário. Claramente, durações e intensidades elevadas em simultâneo não fazem bem à saúde.
O envelhecimento e o seu impacto na imunosenescência
A deterioração do sistema imunitário com a idade deve-se principalmente a factores biológicos, como a genética e às interacções com factores ambientais (como a exposição a agentes infecciosos, incluindo citomegalovírus), impondo alterações metabólicas causadas por estilos de vida não saudáveis (exercício inadequado, dieta inadequada) e stress fisiológico prolongado5,6.
A imunosenescência associada ao envelhecimento acontece pelo menos através dos seguintes três fenómenos: 1) redução na resposta imunitária; 2) aumento da inflamação e oxidação (em inglês inflammaging e oxi-inflammaging); 3) produção e libertação de auto-anticorpos.
No caso do primeiro, o envelhecimento influencia principalmente a imunidade através de alterações na estrutura e actividade do timo (i.e., atrofia do timo), uma glândula com importantes funções imunitárias localizada entre os pulmões, da redução na produção de linfócitos (linfopoiese primária)7,8, do declínio das células T ingénuas, da acumulação das células T memória e de uma diminuição na produção de anticorpos9-11. O envelhecimento também está associado ao declínio das células estaminais hematopoiéticas (hemocitoblastos) e à função das células progenitoras, resultando num aumento da produção de células da linhagem mielóide e diminuição no potencial linfóide12.
No que diz respeito ao segundo, o envelhecimento poderá contribuir para o aumento da secreção de citocinas inflamatórias (interleucina-1 [IL-1], factor de necrose tumoral alfa [TNF-α], interleucina-6 [IL-6] e proteína C reactiva [PCR])13. Com o avançar da idade, os macrófagos, que actuam como sentinelas e residem nos tecidos conjuntivos e orgãos do corpo, tornam-se mais pró-inflamatórios, libertando maiores quantidades de TNF-α e de interleucina-12 (IL-12)14, o que pode acelerar os danos nos tecidos.
Finalmente, no que concerne ao terceiro, o aumento da produção e libertação de auto-anticorpos poderá levar a um aumento de manifestações auto-imunes15,16.
Efeitos do exercício na imunosenescência
Muitos trabalhos têm demonstrado que um estilo de vida fisicamente activo pode ter efeitos positivos no envelhecimento do sistema imunitário17,18. Em particular, o exercício físico regular parece afectar os processos de envelhecimento do sistema imunitário inato (também chamado de não específico) e adaptativo (também chamado de específico ou adquirido). Por exemplo, um dos testes mais robustos para medir a competência imune é a resposta mediada por anticorpo ou célula a novos antígenos, frequentemente administrados experimentalmente por vacinação. As respostas humorais (imunidade mediada pelos linfócitos B) e celulares (imunidade mediada pelos linfócitos T) à vacinação parecem ser mais fortes nos indivíduos activos em comparação com os indivíduos sedentários e mais fortes também naqueles que realizaram formas de exercício estruturado nos meses que antecederam a administração da vacina19,20.
O exercício regular no envelhecimento parece estar associado a um melhor funcionamento das células natural killer (NK)21, a primeira classe de glóbulos brancos a actuar em resposta a qualquer vírus, bactéria ou tumor. Da mesma forma, o funcionamento dos neutrófilos parece ser afectado positivamente, uma vez que idosos saudáveis e mais activos têm uma melhor migração de neutrófilos em direcção à interleucina-8 (IL-8)22, uma citocina com efeitos na angiogénese23 (formação de novos vasos sanguíneos) e, potencialmente, no desenvolvimento muscular. As intervenções com exercício demonstraram diminuir o número de monócitos inflamatórios circulantes CD16+24 (o termo CD significa “cluster of differentiation” e surgiu como forma de diferenciar as diferentes classes de células imunológicas) e a melhorar a função dos neutrófilos e a fagocitose em pacientes com artrite reumatóide25.
Estudos transversais antigos em idosos demonstraram que mulheres altamente treinadas mostraram uma melhoria na proliferação de células T induzidas por mitógeno em comparação com um grupo não treinado21. A melhoria da proliferação das células T também foi relatada noutro estudo de corredores idosos que treinaram uma média de 17 anos. Estes resultados foram associados com um melhor funcionamento do sistema imunitário adaptativo26 e sugerem que uma capacidade cardiovascular aumentada previne a acumulação de células T senescentes.
Devido a estas descobertas, Minuzzi et al.27 recrutaram 19 atletas master (mais de 40 anos) com 20 anos de experiência de treino e compararam o seu sistema imunitário com um grupo de controle sedentário composto por dez indivíduos com idades aproximadas. Neste estudo, os investigadores concluiram que o exercício tem a capacidade de não apenas prevenir a acumulação das células T senescentes ao longo da vida, como também de potenciar a sua exclusão através de mecanismos como a apoptose. Assim, estes dados revelam-nos que o treino físico regular é capaz de reverter as alterações associadas com a idade nas subpopulações de linfócitos e de reduzir parcialmente o declínio das funções das células T relacionadas com a idade.
Num estudo57 publicado recentemente (Março 2020), com dados recolhidos num hospital de Whuan (China), aparentemente a cidade que se tornou o epicentro da pandemia covid-19, os autores sugeriram que a linfopenia (contagem reduzida de linfócitos no sangue) é um indicador eficaz para predizer a severidade dos sintomas do covid-19 e propuseram um modelo de classificação de risco com base na percentagem de linfócitos no sangue. Neste trabalho, os autores verificaram que os indíviduos com uma percentagem de linfócitos mais baixa, tinham pior prognóstico e maior risco de mortalidade.
O músculo esquelético como um órgão imuno-regulador
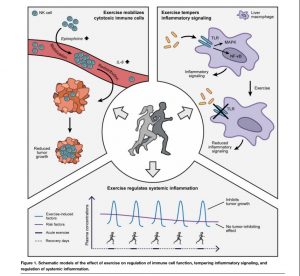
O músculo esquelético é reconhecido como um órgão endócrino capaz de expressar e secretar citocinas (conhecidas como miocinas ou mioquinas) no sistema circulatório durante a actividade física28. A interleucina-6 (IL-6) foi a primeira miocina identificada e pode ser considerada uma das mais eficazes na regulação do sistema imunitário. A IL-6 é produzida logo após o início da actividade física e os níveis produzidos dependem de vários factores como a intensidade do exercício, a duração do exercício e a quantidade de massa muscular utilizada29. Na verdade, as nossas células musculares já produzem IL-6 basal mas o exercício pode aumentar essa libertação em mais de 100 vezes30.. Mas há aqui uma questão muito importante a destacar e que normalmente gera alguma confusão. Por um lado, a IL-6 produzida através das contracções musculares exerce um potente efeito anti-inflamatório (via c-Jun terminal kinase/activador proteína-131) que leva à produção de outros mediadores regulatórios como interleucina-10 (IL-10), receptor antagonista da interleucina-1 (IL-1RA) e à inibição do factor de necrose tumoral alfa (TNF-α) pelos monócitos e macrófagos32,33. Mais, a IL-6 também estimula a libertação de cortisol pelas glândulas supra-renais, proporcionando assim um segundo sinal anti-inflamatório34. Por outro lado, a IL-6 derivada da via de sinalização factor nuclear-kB (NF-kB35) tem um efeito pró-inflamatório e está naturalmente associada a estados de inflamação crónica e de fraca saúde. Recentemente, numa análise a 150 pacientes infectados de dois hospitais em Whuan (China), Ruan et. al.58, verificaram que as concentrações de IL-6 diferiam significativamente entre sobreviventes e não sobreviventes do covid-19, com os não sobreviventes a registar valores 1,7 vezes mais altos, indicando que a IL-6 elevada (não aquela derivada das contracções musculares) também tem repercussões negativas na imunidade. Pode fazer algumas respirações diafragmáticas agora 🙂
Além da IL-6, outras citocinas como a interleucina-736 (IL-7) e interleucina-1537 (IL-15), expressam-se também através das contracções musculares. A IL-7 é necessária para o desenvolvimento de timócitos38 e tanto a IL-7 como a IL-15 são factores proliferativos de linfócitos (especialmente para as células T ingénuas39), que têm tendência a diminuir com a idade e com a inactividade física40. A IL-15 proveniente do músculo ainda aumenta a actvidade das células natural killer (NK) e tem uma influência na redução de gordura através da inibição da lipogénese41. Outras miocinas libertadas pelos músculos também têm sido apontadas na literatura pelos seus efeitos metabólicos e imunológicos, contudo é importante ter presente que os músculos podem segregar mais de 600 miocinas e que ainda há muito por investigar nesta área de estudo, a que alguns autores já designam de “miocinoma”42.
De facto, o treino ao longo da vida também parece afectar os níveis basais de citocinas pró e anti-inflamatórias. Neste estudo levado a cabo por Minuzzi et. al.43, que teve como objectivo analisar os efeitos do envelhecimento e do treino ao longo da vida nas principais citocinas pró e anti-inflamatórias, ficou expresso que os níveis de IL-1RA, interleucina-1 beta (IL-1β), interleucina-4 (IL-4) e interleucina-8 (IL-8) de atletas master estavam mais equilibrados quando comparados com dois grupos sedentários de idade semelhante e de idade mais jovem.
Portanto, o músculo esquelético deve ser visto como a nossa farmácia endógena, um património importante a preservar ao longo da vida que vai ajudar a aumentar a imunidade. Uma reserva de nutrientes e aminoácidos que vai defender o corpo em situações de doença e na recuperação de qualquer evento traumático. Logo, um investimento no desenvolvimento de saúde e imunidade passa desde logo por manter a massa muscular e um estilo de vida activo.
Efeitos agudos e efeitos crónicos do exercício na imunidade
A evidência indica que os mecanismos associados à alteração da função imunitária com o exercício estão relacionados com vários factores, como estímulos do sistema neuroendócrino (catecolaminas, cortisol), estímulos metabólicos (i.e., hidratos de carbono, antioxidantes ou prostaglandinas)44,45, bem como com o débito cardíaco, fluxo sanguíneo, pressão arterial, forças de cisalhamento, entre outros. Alguns estudos parecem sugerir que os efeitos agudos do exercício (e.g., apoptose de algumas células) podem estimular a mobilização de células estaminais hematopoiéticas da medula óssea e de células imunes senescentes dos tecidos periféricos para a circulação46.
Mas a resposta imunitária aguda ao exercício depende da duração e intensidade do mesmo. No âmbito da revisão efectuada por Nieman et. al.4, os autores diferenciaram exercício moderado e vigoroso, utilizando um limiar de intensidade de 60% do VO2 máximo e frequência cardíaca de reserva, e um limiar de duração de 60 minutos. O exercício agudo estimula o intercâmbio de células e componentes do sistema imunitário inato entre os tecidos linfóides e o sangue. Embora transitório, ocorre um efeito cumulativo ao longo do tempo, com melhor vigilância imunitária contra agentes patogénicos, células cancerígenas e uma diminuição da inflamação sistémica4. É por este motivo que tanto a saúde como a imunidade constroem-se todos os dias e não com shots de imunidade, com exercício pouco consistente ou com programas de transformação corporal de curto prazo.
Durante exercícios aeróbios de intensidade moderada e vigorosa em períodos de duração inferior a 60 minutos, a actividade protectora dos macrófagos teciduais ocorre paralelamente a uma recirculação aprimorada de imunoglobulinas, citocinas anti-inflamatórias, neutrófilos, células NK, células T citotóxicas e células B imaturas, que são essenciais na melhoria da saúde imunitária e na saúde metabólica. Estas sessões curtas de exercício de intensidade moderada mobilizam preferencialmente as células NK e as células T CD8+, que exibem alta citotoxicidade e vão atacar especificamente as células infectadas. Ao longo do tempo esta imunovigilância vai aumentando e, naturalmente, o potencial terapêutico do exercício também.
Muitos estudos sustentam que altas cargas de trabalho, competições e o stress fisiológico, metabólico e psicológico associados estão ligados à disfunção imunitária, à inflamação, ao stress oxidativo e ao dano muscular. De facto, vários biomarcadores da função imunitária podem ficar alterados durante várias horas a dias durante a fase de recuperação, mas isto acontece especialmente no caso dos indivíduos que fazem exercício prolongado e intenso, como por exemplo maratonas. A ligação entre exercício intenso e prolongado e o aumento do risco de doença já tem sido estudada desde os anos 80 / início dos anos 90. Os primeiros estudos epidemiológicos indicaram que os atletas envolvidos em eventos de maratona, ultramaratona e/ou de intensidades muito elevadas estavam em risco aumentado de infecções do trato respiratório superior.
Na realidade, quando analisamos os estudos realizados neste âmbito (relação entre exercício vigoroso e doença), verificamos que a maioria foram realizados com atletas de endurance (maratonistas, ultramaratonistas, triatletas, nadadores, esquiadores) e com atletas de elite, indivíduos que são submetidos a cargas de trabalho e a níveis de stress bastante diferentes de um atleta recreativo. O custo de se tornar um atleta de elite será sempre a saúde e como tal não podemos comparar laranjas com maçãs. Embora Campbell et. al.47 tenham desafiado o significado clínico e a ligação entre esforço intenso e disfunção imunitária transiente (uma questão que irá ser explorada mais abaixo), a maioria dos investigadores na área da imunologia do exercício apoia a posição que o sistema imunitário reflecte a magnitude do stress fisiológico imposto ao seu praticante. Mas atenção, isto não significa que a intensidade não possa ser elevada, isto significa é que a intensidade e outras variáveis do treino precisam de ser geridas de forma criteriosa.
Influências clínicas do exercício crónico nas infecções respiratórias
Cada período de actividade física moderada promove melhorias transientes na imunovigilância e, quando repetida regularmente, confere múltiplos benefícios à saúde, incluindo menor incidência de doenças respiratórias e inflamação. Os ensaios clínicos randomizados (8 semanas a 1 ano de duração)21,49-53 são consistentes na demonstração que os indivíduos que participam em programas de exercício moderado ou meditação52,53, experimentam menor incidência e duração de infecções do trato respiratório superior. A magnitude da redução destes sintomas com a realização de exercícios moderados quase diários é geralmente de 40% a 50%, excedendo os níveis relatados para a maioria dos medicamentos e suplementos.
Neste estudo efectuado por Nieman et. al.48, foram seguidos durante 12 semanas um grupo de 1002 adultos (18-85 anos; 60% mulheres e 40% homens), metade durante o inverno e a outra metade durante o outono, com a finalidade de monitorizar os sintomas de infecções do trato respiratório superior. Os resultados indicaram que o número de dias com infecções respiratórias foi 43% menor em indivíduos envolvidos numa média de cinco ou mais dias por semana de exercício aeróbio (20 minutos ou mais) em comparação com os indivíduos sedentários (≤ 1 dia / semana) e 46% menor para aqueles que estavam em melhor forma física.
Adicionalmente, conforme referido na secção “efeitos do exercício na imunosenescência”, há também uma melhoria na resposta de anticorpos à imunização contra o vírus da gripe em idosos que incorrem em programas regulares de exercício físico20.
O mito da supressão imunitária induzida pelo exercício
Num artigo de revisão publicado há cerca de dois anos atrás, Campbell et. al47, colocaram algumas questões relevantes, que devem merecer a nossa atenção. Os estudos que indicaram um maior número de infecções do trato respiratório superior decorrentes da “actividade física”, além de terem sido auto-reportadas (i.e., não foram efectivamente medidas através de análises laboratoriais), foram realizados em maratonistas e ultramaratonistas, sugerindo que essas infecções têm maior probabilidade de acontecer quando a duração e a intensidade do exercício são muito elevadas. Por outro lado, é preciso ter presente que essas infecções poderão também ser o resultado de muitas outras causas, algumas mais directamente associadas com essas práticas desportivas (cargas de trabalho muito elevadas, alergia, asma, inflamação não específica das mucosas, hiperventilação própria do exercício, exposição a temperaturas mais frias) e outras de carácter mais geral mas não menos importantes (maior stress psicológico, ansiedade, deficiências nutricionais, exposição a grandes aglomerados populacionais, fadiga, sono inadequado, viagens e adaptação a novos fusos horários, desidratação). Isto significa que o sistema imunitário poderá já estar em maior risco antes de iniciar o exercício. Assim, da mesma forma que existe evidência (com as devidas limitações) a confirmar que o exercício pode aumentar o risco de infecção, também existem vários estudos epidemiológicos a indicar que o exercício pode reduzir o risco de infecção, inclusivamente em atletas de elite, que estão sujeitos a elevadas cargas de trabalho.
Outro pilar da imunologia do exercício que recebeu considerável atenção nas últimas três décadas é a avaliação das alterações induzidas pelo exercício na imunidade das mucosas, principalmente através da medição dos níveis de anticorpos da imunoglobulina A (IgA) na saliva. A função principal da IgA é prevenir a entrada de organismos invasores na circulação e como tal a sua concentração aumentada ou diminuída poderá revelar uma imunidade mais forte ou mais fraca, respectivamente. Mais uma vez, os estudos aqui estão divididos e os autores apontam várias limitações que podem deturpar a secrecção de IgA: os níveis absolutos de IgA relatados não controlaram adequadamente a quantidade de saliva produzida; o estado da saúde oral é raramente avaliado; ritmo circadiano; stress psicológico; género; etnia, doença; medicamentos; tabaco e fase do ciclo menstrual. Pelo que é arriscado dizer-se que quaisquer alterações subtis na IgA salivar após o exercício reflectem a supressão imunitária e um risco aumentado de infecções oportunistas.
Já constatamos que o sistema imunitário é estimulado durante o exercício mas nas horas após o exercício, geralmente é observado que a frequência e capacidade funcional dos linfócitos do sangue periférico diminui para níveis inferiores ao pré-exercício, levando alguns autores a propor que o exercício induz uma janela de imunosupressão, fenómeno designado de “janela aberta”. Mas em vez de suprimir a competência imune, um ponto de vista mais actual é que essa linfopenia aguda e transitória 1 a 2h após o exercício é benéfica para a vigilância e regulação imunitária. De facto, no que parece ser uma resposta altamente especializada e sistemática, tem sido proposto que o exercício vai, por via da estimulação adrenérgica e libertação de adrenalina, mobilizar as células imunitárias para a circulação e depois redistribuir essas mesmas células para os tecidos periféricos (i.e., superfícies mucosas como pulmões, intestino, pele) para conduzir a vigilância imunológica e providenciar feedback à medula óssea para iniciar a produção de novas células imunitárias. Estas células imunitárias são recrutadas do baço, dos nódulos linfáticos, do intestino e de células imobilizadas ao longo das paredes vasculares. Esta redistribuição das células imunitárias (em particular das células NK) é, na verdade, um dos mecanismos apontados para a redução dos tumores em pacientes com cancro54,55 (infelizmente esta forma de imunoterapia ainda não é levada a sério) e o seu aumento é proporcional à intensidade do exercício56.
Para haver adaptações significativas ao nível do treino é preciso que o mesmo seja progressivamente intenso. Intenso não significa necessariamente mais longo, significa intenso para o indivíduo que está a realizar o exercício. E para fazê-lo de forma responsável, é preciso atender ao seu historial clínico, à sua mobilidade articular e à sua capacidade de trabalho, ou seja, é preciso avaliar o indivíduo para poder compreender a sua tolerância. Um indivíduo que treina de forma consistente há muitos anos terá respostas diferentes ao nível do sistema imunitário quando comparado com um indivíduo sedentário ou pouco regular no exercício. Tal como qualquer intervenção cirúrgica, o exercício também precisa de ser bem administrado para ser eficaz.
Conclusão
Vivemos numa cultura de elevado sedentarismo em que não é necessário fazer qualquer tipo de esforço físico para sobreviver. As pessoas habituaram-se a não fazer nada do ponto de vista físico para sobreviver mas agora de repente parece que descobriram que podem e devem ser mais activas. A disseminação de exercícios sem critério e de aulas online gratuitas nestes últimos tempos tem sido própria da histeria que se vive num arraial. A falta de consciência de alguns profissionais, que certamente estão a tentar ajudar, também não tem ajudado. O que mais me preocupa nesta história toda é que na internet vale tudo e não há qualquer tipo de filtro. E devido a esta falta de cultura e literacia física colectiva, a maior parte das pessoas não tem educação suficiente para distinguir o bom do mau, nem o excelente do medíocre. Qualquer coisa serve, independentemente se tem qualidade ou não.
Para quem não sabe para onde vai qualquer caminho serve, disse o gato na célebre história de Alice no País das Maravilhas, em resposta à sua exclamação “eu não sei para onde quero ir!”. Esta questão do covid-19 veio confirmar que a atitude diária das pessoas rege-se mais pelo medo, que pelos seus objectivos e desejos. Os media sabem disso e exploram muito bem essa fragilidade das pessoas. O bombardeamento de informação sobre esta matéria tem sido estridente e hoje em dia é cada vez mais difícil distinguir a verdade da mera opinião de jornalistas e de pseudo-especialistas. O medo é o principal supressor do sistema imunitário, o cortisol e as hormonas do stress vão superar a energia necessária para combater a infecção. Esta é uma questão que decorre da nossa evolução enquanto espécie, se estivesse doente e tivesse que fugir de um animal que me queria fazer mal, eu iria canalizar toda a minha energia para esse efeito, ou seja, eu iria lutar com todas as minhas forças para combater esse animal. A situação do covid-19 veio confirmar também que temos uma população débil que investe muito pouco no desenvolvimento da sua saúde e imunidade. E quanto maior o número de comorbilidades, sinais e sintomas de perda de saúde, maior é o risco de adoecer e morrer.
Em relação ao exercício físico, e com base na revisão de literatura efectuada e na nossa experiência prática no acompanhamento de indivíduos imunossuprimidos, maioritariamente doentes oncológicos, há várias coisas que deve fazer para aumentar a sua imunidade e bem-estar geral. Aqui ficam as principais recomendações:
- Mantenha-se o mais activo possível e evite passar muito tempo seguido sentado. Passar muito tempo sentado é altamente nocivo! Tenha presente que o movimento sempre foi uma necessidade essencial à vida humana e afecta todos os sistemas e órgãos do corpo. O facto de hoje não ter problemas de saúde devido ao seu comportamento sedentário é apenas uma questão de tempo. (nota: manter-se activo no seu dia a dia não é igual a manter as suas articulações, a sua postura, a sua musculatura e a sua competência de movimento em bom estado. Para optimizar a sua função corporal e retirar maiores benefícios precisa de dedicar tempo à avaliação e ao tratamento da sua condição músculo-esquelética).
- Seja consistente na sua adesão ao exercício físico. Procure formas de exercício prazerosas, que lhe permita manter uma frequência semanal elevada (5-6x por semana, idealmente). A intensidade deverá naturalmente oscilar entre moderada e vigorosa. Há um efeito cumulativo na construção da imunidade. Os indivíduos que são mais consistentes ao nível da sua prática de exercício estruturado têm menor incidência de doenças, registam uma maior eficácia ao nível da vacinação e têm um sistema imunitário mais vigilante. A prática de meditação também tem mostrado resultados na prevenção de infecções respiratórias, e é importante na gestão do stress e na melhoria do bem-estar geral.
- Em função da sua condição, privilegie formas de exercício seguras que permitam realizar intensidades elevadas de curta duração (a evidência aponta como limiar 60 minutos de duração) ao invés de intensidades elevadas de longa duração. A lógica do “no pain, no gain” é simplesmente imbecil e só faz sentido se você não estiver preocupado com a sua saúde e longevidade. Os eventos de endurance de intensidade elevada poderão suprimir o sistema imunitário e aumentar o risco de doença e infecção do trato respiratório, especialmente se não tiver os cuidados adicionais na sua preparação. No que diz respeito à intensidade, podemos compreendê-la de duas formas: 1) intensidade ao nível da activação neuromuscular / contracção muscular (com a utilização de vários protocolos de treino de força) e 2) intensidade ao nível da capacidade dos sistemas energéticos (com a utilização de vários protocolos de treino de métodos intervalados e/ou de métodos contínuos). Intensidades elevadas, se pensarmos numa escala de 1 a 10, em que 1 é pouco intenso e 10 muito intenso, referimo-nos a uma percepção de esforço de oito para cima.
- Em função da sua condição, privilegie programas de treino baseados no desenvolvimento de motricidade e literacia física, que fomentem a (re)aprendizagem de padrões de movimento fundamentais (agachar, empurrar, puxar, levantar, carregar, rodar, locomoção) de forma assistida ou resistida, com variabilidade de movimento consequente, no desenvolvimento atlético e que envolvam maiores quantidades de massa muscular. Quanto maior a massa muscular envolvida e a intensidade aplicada, maior será a comunicação cruzada entre os seus músculos e os vários sistemas do corpo, entre os quais o sistema imunitário. Reforço mais uma vez: a intensidade pode ser benéfica mas precisa de ser bem gerida. Não esqueçamos aquela célebre frase utilizada na Medicina: a dose certa é o que diferencia o veneno do remédio.
- Em função da sua condição, privilegie programas de treino que potenciem o desenvolvimento de mobilidade articular, de força e de massa muscular. O desenvolvimento de mobilidade vai melhorar a saúde das suas articulações, optimizar amplitudes de movimento e desbloquear o seu potencial de movimento. O desenvolvimento de força será fundamental para manter a autonomia motora e a independência funcional nas tarefas diárias / desportivas. O desenvolvimento de massa muscular irá contribuir para aumentar a sinalização anti-inflamatória e imuno-reguladora ao longo da sua vida. O músculo é a farmácia endógena do ser humano mas este precisa do estímulo certo para poder manter-se saudável e funcional.
Finalmente, se ainda está a pensar nos 60 minutos de duração do exercício como o critério fundamental para a sua prática, não está a pensar bem. O aspecto mais importante será mesmo a prescrição de exercício com qualidade, será a qualidade do exercício que irá resolver os seus problemas de saúde, melhorar a sua função corporal e o seu bem-estar geral. Porque se o mesmo for prescrito com qualidade a duração da sua prática torna-se um factor acessório.
Bons treinos!
Pedro Correia
Referências:
1. Weyh C, Krüger K, Strasser B. Physical Activity and Diet Shape the Immune System during Aging. Nutrients. 2020 Feb 28;12(3). pii: E622. doi:10.3390/nu12030622. Review. PubMed PMID: 32121049.
2. Van Dijk JG, Matson KD. Ecological immunology through the lens of exercise immunology: new perspective on the links between physical activity and immune function and disease susceptibility in wild animals. Integr Comp Biol 2016;56:290–303.
3. Larrabee RC. Leukocytosis after violent exercise. J Med Res (NS) 1902;7:76–82.
4. Nieman DC, Wentz LM. The compelling link between physical activity and the body’s defense system. J Sport Health Sci. 2019 May;8(3):201-217. doi:10.1016/j.jshs.2018.09.009. Epub 2018 Nov 16. Review. PubMed PMID: 31193280;PubMed Central PMCID: PMC6523821.
5. Janeway C. Immunobiology: The Immune System in Health and Disease. London, UK: Current Biology Publications (1999).
6. Reed RG, Raison CL. Stress and the immune system. In: E Charlotte editor. Environmental Influences on the Immune System. Vienna: Springer (2016). 97–126. doi: 10.1007/978-3-7091-1890-0_5.
7. AwD, Silva AB, Palmer DB. The effect of age on the phenotype and function of developing thymocytes. J Comp Pathol. (2010) 142 Suppl 1:S45–59. doi: 10.1016/j.jcpa.2009.10.004.
8. Palmer DB. The effect of age on thymic function. Front Immunol. (2013) 4:316. doi: 10.3389/fimmu.2013.0031.
9. Agrawal A, Agrawal S, Gupta S. Dendritic cells in human aging. Exp Gerontol. (2007) 42:421–6. doi: 10.1016/j.exger.2006.11.007.
10. Agrawal A, Agrawal S, Tay J, Gupta S. Biology of dendritic cells in aging. J Clin Immunol. (2008) 28:14–20. doi: 10.1007/s10875-007-9127-6.
11. Montecino-Rodriguez E, Berent-Maoz B, Dorshkind K. Causes, consequences, and reversal of immune system aging. J Clin Invest. (2013) 123:958–65. doi: 10.1172/JCI64096.
12. Akunuru S, Geiger H. Aging, clonality, and rejuvenation of hematopoietic stem cells. Trends Mol Med. (2016) 22:701–12. doi: 10.1016/j.molmed.2016.06.003.
13. Michaud M, Balardy L, Moulis G, Gaudin C, Peyrot C, Vellas B, et al. Proinflammatory cytokines, aging, and age-related diseases. J Am Med Dir Assoc. (2013) 14:877–82. doi: 10.1016/j.jamda.2013.05.009.
14. Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. (2008) 8:958–69. doi: 10.1038/nri2448.
15. Watad A, Bragazzi NL, Adawi M, Amital H, Toubi E, Porat BS, et al. Autoimmunity in the elderly: insights from basic science and clinics – a mini-review. Gerontology (2017) 63:515–23. doi: 10.1159/000478012.
16. Ramos-Casals M, García-Carrasco M, Brito MP, López-Soto A, Font J. Autoimmunity and geriatrics: clinical significance of autoimmune manifestations in the elderly. Lupus (2003) 12:341–55. doi: 10.1191/0961203303lu383ed.
17. Simpson, R.J.; Lowder, T.W.; Spielmann, G.; Bigley, A.B.; LaVoy, E.C.; Kunz, H. Exercise and the aging immune system. Aging Res. Rev. 2012, 11, 404–420.
18. Duggal, N.A.; Niemiro, G.; Harridge, S.D.R.; Simpson, R.J.; Lord, J.M. Can physical activity ameliorate immunosenescence and thereby reduce age-related multi-morbidity? Nat. Rev. Immunol. 2019, 19, 563–572.
19. A. R. Pascoe, M. A. Fiatarone Singh, and K. M. Edwards, “The effects of exercise on vaccination responses: a review of chronic and acute exercise interventions in humans,” Brain, Behavior, and Immunity, vol. 39, pp. 33–41, 2014.
20. A. L. de Araújo, L. C. Silva, J. R. Fernandes et al., “Elderly men with moderate and intense training lifestyle present sustained higher antibody responses to influenza vaccine,” Age (Dordrecht, Netherlands), vol. 37, no. 6, p. 105, 2015.
21. Nieman, D.C.; Henson, D.A.; Gusewitch, G.; Warren, B.J.; Dotson, R.C.; Butterworth, D.E.; Nehlsen-Cannarella, S.L. Physical activity and immune function in elderly women. Med. Sci. Sports Exerc. 1993, 25, 823–831.
22. Bartlett, D.B.; Fox, O.; McNulty, C.L.; Greenwood, H.L.; Murphy, L.; Sapey, E.; Goodman, M.; Crabtree, N.; Thøgersen-Ntoumani, C.; Fisher, J.P.; et al. Habitual physical activity is associated with the maintenance of neutrophil migratory dynamics in healthy older adults. Brain Behav. Immun. 2016, 56, 12–20.
23. Frydelund‐Larsen, L., Penkowa, M., Akerstrom, T., Zankari, A., Nielsen, S. and Pedersen, B.K. (2007), Exercise induces interleukin‐8 receptor (CXCR2) expression in human skeletal muscle. Experimental Physiology, 92: 233-240.
24. Timmerman, K. L., Flynn, M. G., Coen, P. M., Markofski, M. M. & Pence, B. D. Exercise training- induced lowering of inflammatory (CD14+CD16+) monocytes: a role in the anti- inflammatory influence of exercise? J. Leukoc. Biol. 84, 1271–1278 (2008).
25. Bartlett, D. B. et al. Ten weeks of high- intensity interval walk training is associated with reduced disease activity and improved innate immune function in older adults with rheumatoid arthritis: a pilot study. Arthritis Res. Ther. 20, 127 (2018).
26. Shinkai, S.; Kohno, H.; Kimura, K.; Komura, T.; Asai, H.; Inai, R.; Oka, K.; Kurokawa, Y.; Shephard, R.J. Physical activity and immune senescence in men. Med. Sci. Sports Exerc. 1995, 11, 1516–1526.
27. Minuzzi, L.G.; Rama, L.; Chupel, M.U.; Rosado, F.; Valente dos Santos, J.; Simpson, R.J.; Martinho, A.; Paiva, A.; Teixeira, A.M. Effects of lifelong training on senescence and mobilization of T lymphocytes in response to acute exercise. Exerc. Immunol. Rev. 2018, 24, 72–84.
28. Pedersen, B. K. & Febbraio, M. A. Muscles, exercise and obesity: skeletal muscle as a secretory organ. Nat. Rev. Endocrinol. 8, 457–465 (2012).
29. Pedersen BK, Steensberg A, Keller P, et al. Muscle-derived interleukin-6: lipolytic, anti-inflammatory and immune regulatory effects. Pflügers Arch Eur J Physiol. 2003;446(1):9-16. doi:10.1007/s00424-002-0981-z.
30. Pedersen BK, Febbraio MA. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6. Physiol Rev. 2008;88(4):1379-1406. doi:10.1152/physrev.90100.2007.
31. Whitham, M. et al. Contraction-induced interleukin-6 gene transcription in skeletal muscle is regulated by c-Jun terminal kinase/activator protein-1. J. Biol. Chem. 287, 10771–10779 (2012).
32. Munoz- Canoves, P., Scheele, C., Pedersen, B. K. & Serrano, A. L. Interleukin-6 myokine signaling in skeletal muscle: a double- edged sword? FEBS J. 280, 4131–4148 (2013).
33. Starkie, R.; Ostrowski, S.R.; Jauffred, S.; Febbraio, M.; Pedersen, B.K. Exercise and IL-6 infusion inhibit endotoxin-induced TNF-alpha production in humans. FASEB J. 2003, 17, 884–886.
34. Bethin, K. E., Vogt, S. K. & Muglia, L. J. Interleukin-6 is an essential, corticotropin- releasing hormone- independent stimulator of the adrenal axis during immune system activation. Proc. Natl Acad. Sci. USA 97, 9317–9322 (2000).
35. Liu, T., Zhang, L., Joo, D. et al. NF-κB signaling in inflammation. Sig Transduct Target Ther 2, 17023 (2017).
36. Haugen, F. et al. IL-7 is expressed and secreted by human skeletal muscle cells. Am. J. Physiol. Cell Physiol. 298, C807–C816 (2010).
37. Rinnov, A. et al. Endurance training enhances skeletal muscle interleukin-15 in human male subjects. Endocrine 45, 271–278 (2014).
38. Shitara, S. et al. IL-7 produced by thymic epithelial cells plays a major role in the development of thymocytes and TCRγδ+ intraepithelial lymphocytes. J. Immunol. 190, 6173–6179 (2013).
39. Wallace, D. L. et al. Prolonged exposure of naive CD8+ T cells to interleukin-7 or interleukin-15 stimulates proliferation without differentiation or loss of telomere length. Immunology 119, 243–253 (2006).
40. Duggal, N. A., Pollock, R. D., Lazarus, N. R., Harridge, S. & Lord, J. M. Major features of immunesenescence, including reduced thymic output, are ameliorated by high levels of physical activity in adulthood. Aging Cell 17, 12750 (2018).
41. Duggal, N.A., Niemiro, G., Harridge, S.D.R. et al. Can physical activity ameliorate immunosenescence and thereby reduce age-related multi-morbidity?. Nat Rev Immunol 19, 563–572 (2019).
42. Whitham M, Febbraio MA. The ever-expanding myokinome: Discovery challenges and therapeutic implications. Nat Rev Drug Discov 15(10): 719-729, 2016.
43. Minuzzi, L.G.; Chupel, M.U.; Rama, L.; Rosado, F.; Muñoz, V.R.; Gaspar, R.C.; Kuga, G.K.; Furtado, G.E.; Pauli, J.R.; Teixeira, A.M. Lifelong exercise practice and immunosenescence: Master athletes cytokine response to acute exercise. Cytokine 2019, 115, 1–7.
44. Mazdarani FH, Khaledi N, Hedayati M. Effects of official basketball competition on the levels of cortisol and salivary immunoglobulin (A) among female children. J Childhood Obesity (2016) 1:12.
45. Pedersen BK, Toft AD. Effects of exercise on lymphocytes and cytokines. Br J Sports Med. (2000) 34:246–51. doi: 10.1136/bjsm.34.4.246.
46. Cao Dinh H, Beyer I, Mets T, Onyema OO, Njemini R, Renmans W, et al. Effects of physical exercise on markers of cellular immunosenescence: a systematic review. Calcif Tissue Int. (2017) 100:193–215.
47. Campbell JP, Turner JE. Debunking the myth of exercise-induced immune suppression: redefining the impact of exercise on immunological health across the lifespan. Front Immunol 2018;9:648.
48. Nieman DC, Henson DA, Austin MD, Sha W. Upper respiratory tract infection is reduced in physically fit and active adults. Br J Sports Med 2011;45:987–92.
49. Nieman DC, Nehlsen-Cannarella SL, Markoff PA, Balk-Lamberton AJ, Yang H, Chritton DB, et al. The effects of moderate exercise training on natural killer cells and acute upper respiratory tract infections. Int J Sports Med 1990;11:467–73.
50. Nieman DC, Nehlsen-Cannarella SL, Henson DA, Koch AJ, Butterworth DE, Fagoaga OR, et al. Immune response to exercise training and/or energy restriction in obese women. Med Sci Sports Exerc 1998;30:679–86.
51. Chubak J, McTiernan A, Sorensen B, Wener MH, Yasui Y, Velasquez M, et al. Moderate-intensity exercise reduces the incidence of colds among postmenopausal women. Am JMed 2006;119:937–42.
52. Barrett B, Hayney MS, Muller D, Rakel D, Ward A, Obasi CN, et al. Meditation or exercise for preventing acute respiratory infection: a randomized controlled trial. Ann Fam Med 2012;10:337–46.
53. Barrett B, Hayney MS, Muller D, Rakel D, Brown R, Zgierska AE, et al. Meditation or exercise for preventing acute respiratory infection (MEPARI-2): a randomized controlled trial. PLoS One 2018;13: e0197778. doi:10.1371/journal.pone.0197778.
54. Christensen JF, Simonsen C, Hojman P. Exercise Training in Cancer Control and Treatment. Compr Physiol. 2018 Dec 13;9(1):165-205.
55. Hojman P. Exercise protects from cancer through regulation of immune function and inflammation. Biochem Soc Trans. 2017 Aug 15;45(4):905-11. doi:10.1042/BST20160466. Epub 2017 Jul 3. Review. PubMed PMID: 28673937.
56. Campbell JP, Riddell NE, Burns VE, Turner M, van Zanten JJ, Drayson MT, Bosch JA. Acute exercise mobilises CD8+ T lymphocytes exhibiting an effector-memory phenotype. Brain Behav Immun. 2009 Aug;23(6):767-75.
57. Tan, L., Wang, Q., Zhang, D. et al. Lymphopenia predicts disease severity of COVID-19: a descriptive and predictive study. Sig Transduct Target Ther 5, 33 (2020).
58. Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020 Mar 3. doi: 10.1007/s00134-020-05991-x. [Epub ahead of print] Erratum in: Intensive Care Med. 2020 Apr 6;:.PubMed PMID: 32125452; PubMed Central PMCID: PMC7080116.
Dado os tempos que vivemos, em que o contacto social está condicionado, proliferam a promoção de serviços à distância em todas as áreas profissionais. Na área do fitness, parece que se descobriu de repente que se pode (e deve) treinar todos os dias e que se pode treinar em casa ou sozinho. É incrível a explosão de publicações nas redes sociais por parte de personal trainers a oferecerem alinhamentos de exercícios para as pessoas executarem em casa. Sabemos que, para uma melhor saúde e resiliência, é fundamental que se faça exercício físico todos os dias, tal como é fundamental alimentar-se e manter a higiene pessoal, mas isto sempre foi assim e, portanto, não é uma necessidade apenas dos tempos actuais. Por isso, publicar um alinhamento de exercícios para todos fazerem vale tanto quanto publicar uma foto do prato de comida ou a lavar os dentes. Serve quanto muito para lembrar-lhe que essas actividades são importantes, mas o conteúdo não é, em grande medida, aplicável a si que lê este texto. Muito menos no que concerne ao exercício. Aliás, pegar no garfo e faca para comer, ou o acto de lavar os dentes são actividades menos complexas do que a execução da maior parte dos exercícios físicos que vemos frequentemente propostos e muito menos a sua organização numa sessão de treino.
A saúde e resiliência resultante do treino é ainda mais relevante em tempos de crise como os que estamos a viver, mas foi sobretudo construída nos meses e anos prévios a este momento. Nomeadamente durante os tais meses e anos que você foi consistentemente ao ginásio fazer o seu treino, muitas vezes com sacrifício. Custa organizar-se de forma a conseguir treinar! Temos família e trabalho e por vezes é complicado conciliar todas as obrigações sociais e profissionais com horários destinados à nossa saúde e bem-estar, neste caso ao treino. E reparem que agora sim falo de treino.
Porque muitos de vocês que estão a ler estas linhas perceberam há muito a diferença entre “fazer exercícios” e treino. Perceberam que “fazer exercícios” é melhor que nada, mas que o treino está a um nível acima. O treino é um processo e obriga a organizar todas as suas variáveis no tempo. Obriga a fazer uma avaliação cuidada da condição inicial, seleccionar exercícios e formas de execução específicas, a observar e avaliar movimento, e fazer os ajustes necessários (e.g. carga, tipo e forma de execução de exercícios) por forma a garantir constante progressão nessa senda da saúde, performance e resiliência. Treinar não é o mesmo que ‘’fazer exercícios” sempre variados e sem critério apenas com o intuito de manter alguma actividade física. E porque alguns percebem essa diferença, têm vindo ao longo dos meses e anos que antecederam os tempos de hoje a fazer os tais sacrifícios organizacionais. E optaram por investir um pouco mais do seu tempo e dinheiro, e regularmente deslocaram-se a um ginásio para obter um serviço de treino. Um serviço em que um programa é seguido, os exercícios não são escolhidos de forma aleatória, e em que a progressão nas cargas utilizadas bem como a execução dos exercícios é monitorizada de perto por um treinador.
Todos os benefícios do treino personalizado são possíveis obter à distância via online. Considero que a forma presencial será sempre superior, mas mediante boa organização e compromisso do treinador e aluno é possível uma progressão constante e essa diferença ser mitigada. Como é que na The Strength Clinic sabemos isso? Porque já o fazemos há vários anos! Além disso, o treino personalizado online pode até ter algumas vantagens em relação ao treino presencial, tais como:
- Não ter que se deslocar ao ginásio a determinada hora. Este aspecto pode ser uma grande vantagem para algumas pessoas. Se for garantida a auto-disciplina de cumprir o seu programa de treino, o tempo de deslocação e o que isso implica em termos organizacionais é poupado. Além disso, poderá escolher uma hora de treino que melhor encaixe no seu horário sem estar condicionado pela disponibilidade do seu treinador;
- Maior consistência e empenho na execução dos exercícios. Visto que pode escolher a hora do seu treino, corre menos riscos de falhar a sua sessão de treino pois terá mais flexibilidade em adaptar o horário. Dessa forma, garante mais facilmente a frequência semanal de treinos desejável. Além disso, como recomendamos que documente em vídeo um resumo de cada treino numa plataforma online para que o seu treinador possa observar, isso encerra também um compromisso adicional no cumprimento da sessão e na boa execução dos exercícios;
- Melhor custo benefício. De facto, poderá usufruir de quase todos os benefícios dum treinador pessoal por um valor mais baixo porque não terá que pagar pelo valor relacionado com despesas de funcionamento e material do local onde ocorreria a sessão de treino presencial;
- Treinar directamente com o seu treinador preferido. Se o treinador com quem gostaria de trabalhar não tem disponibilidade presencial ou o seu valor presencial é acima das suas possibilidades, a alternativa online irá possibilitar trabalhar directamente com ele.
A mensagem “não deixe de treinar mesmo que seja em casa ou sozinho” no contexto das adversidades que vivemos hoje está correcta! Contudo, esta necessidade não surgiu hoje. É algo que deveria fazer parte das nossas vidas se nos queremos manter mais fortes e saudáveis desde sempre. Para este efeito, treinar é muito melhor do que apenas “fazer exercícios”, sobretudo se retirados de publicações nas redes sociais sem qualquer critério ou consciência corporal e sem programação futura. Serve apenas para “mexer o corpo” e ficar cansado no momento, mas não passará disso mesmo. Porque treinar implica um processo que tem por base os seus objectivos e características individuais. Numa sessão de treino, aquilo que se faz hoje foi em função do que se fez ontem e do que se vai fazer no futuro. E é possível continuar a treinar online e retirar todos os benefícios do treino personalizado, mesmo que à distância. Obriga a um empenho mútuo do aluno e treinador num processo que é conjunto. Esse desenvolvimento pessoal optimizado será sempre o nosso compromisso na The Strength Clinic para consigo. Estamos aqui para guiá-lo nesse processo e não para oferecer treinos “chapa 5” para todos!
Bons treinos!
Nuno Correia
“As pessoas não decidem o seu futuro, as pessoas decidem os seus hábitos e os seus hábitos decidem o seu futuro.”
– F. M. Alexander
Há nove anos atrás (2010)1, o European Working Group on Sarcopenia in Older People (EWGSOP) publicou uma definição de sarcopenia que foi amplamente utilizada em todo o mundo e essa definição fomentou avanços na identificação e no cuidado de pessoas em risco ou com sarcopenia. Ficou definida como uma síndrome caracterizada pela perda progressiva e generalizada de massa muscular e força com risco de resultados adversos, como incapacidade física, pobre qualidade de vida e morte. Porque a relação entre massa muscular e força não é linear (a capacidade de gerar força não depende apenas da massa muscular), os critérios para o seu diagnóstico incluíam baixa massa muscular e baixa função muscular (i.e força ou performance física).
Depois de sabermos que, em 2016, a sarcopenia foi classificada como uma doença pela Organização Mundial de Saúde, conforme foi referido na primeira parte deste artigo, o EWGSOP22 actualizou a sua definição operacional e as várias estratégias de diagnóstico, considerando agora que a força muscular (medida através da força de preensão ou do teste de levantar-se da cadeira) é o principal parâmetro para medir a função muscular, ainda mais importante que a quantidade de massa muscular. Portanto, é neste contexto, que justificamos o título deste artigo e que reforçamos a importância de partilhar esta mensagem com todos os profissionais de saúde.
As implicações desta condição na saúde humana são várias e largamente conhecidas: aumento do risco de quedas e fracturas3,4; prejudica a realização das actividades da vida diária5; está associada com doença cardíaca6, doença respiratória7 e disfunção cognitiva8; menor qualidade de vida9; perda de independência10,11,12 e morte13. Em termos financeiros, os custos na saúde pública também já foram calculados em vários trabalhos. Num estudo de Janssen et. al.14, em 2004, os custos da sarcopenia nos Estados Unidos foram estimados em 18,5 biliões de dólares anuais, representando cerca de 1,5% dos custos totais na saúde. Num estudo realizado cá em Portugal no Hospital de Santo António no Porto e publicado em 201615, verificou-se que os custos de hospitalização associados à sarcopenia foram superiores em 58,5% para pacientes com idade inferior a 65 anos e em 34% para pacientes com idade igual e superior a 65 anos. Mais recentemente (2018), no Hertfordshire Cohort Study no Reino Unido16, verificou-se que os custos associados com a falta de força muscular foram estimados em 2,5 biliões de libras anuais.
No cenário actual, em que o fenótipo do envelhecimento doentio prolifera a olhos vistos em todas as nações industrializadas, em que doenças como a hipertensão, o cancro, a depressão, o alzheimer e a diabetes tipo II estão a acabar com a vida das pessoas, é fundamental adoptar medidas que visem a melhoria da função de cada indivíduo ao invés do diagnóstico de doenças e da administração de medicamentos que, além de não contribuírem para resolver este problema, poderão ainda agravar a sua condição. Sabemos que os problemas de saúde principais estão relacionados com a má alimentação, com a inactividade física, com a falta de sono, com o excesso de álcool, com a exposição ao tabaco e aos ambientes poluídos mas também com a falta de movimento de qualidade, de vigor e de força muscular.
Os benefícios do treino de força na saúde estão bem sustentados na literatura científica e os mais importantes serão porventura os seguintes: diminuição da pressão arterial; diminuição do risco de osteoporose e sarcopenia; melhoria do perfil lipídico; aumento da capacidade cardiorespiratória; prevenção e gestão de dores crónicas; aumento da sensibilidade à insulina; melhoria do bem estar e auto-confiança. Mais, já são vários os estudos17,18,19 que têm mostrado uma forte e consistente correlação entre o aumento de força e massa muscular com a diminuição da mortalidade, reforçando o facto que o declínio da força associado aos níveis de sedentarismo actuais e ao envelhecimento precisam de ser tratados. Logo, um programa de treino de força bem desenhado, que atenda à competência do indivíduo e que respeite os princípios do treino, vai melhorar todos os indicadores de saúde atrás referidos e ainda todas as qualidades físicas necessárias (força, potência, velocidade, agilidade, equilíbrio, coordenação, mobilidade, endurance) para a realização das actividades da nossa vida diária. São estes parâmetros da função física que estão actualmente sendo propostos como biomarcadores do envelhecimento nos seres humanos20.
Por consequência, a programação do treino é que será o factor determinante nesta equação. E se é certo que este processo requer o conhecimento imperativo das ciências do desporto, é preciso não esquecer que o mesmo também requer trabalho aplicado no terreno e arte na instrução. Em vez de andarmos tão preocupados em seguir as guidelines e procurarmos pelos resultados estatisticamente significativos, devemos sim preocupar-nos que a nossa abordagem seja relevante para a vida da pessoa. Porque nós trabalhamos com pessoas. Pessoas que têm limitações de tempo para treinar. Pessoas com diferentes responsabilidades familiares e profissionais. Pessoas que têm vidas diferentes umas das outras. Pessoas que têm uma série de problemas metabólicos e/ou ortopédicos que nenhum estudo randomizado controlado jamais conseguirá reproduzir! Sim, este é um processo complexo.
Finalmente, sabemos que um dos mecanismos responsáveis pela atrofia muscular, sarcopenia e envelhecimento é a apoptose, a morte programada das células e um processo fundamental no envelhecimento. Mas quando treinamos, comemos e descansamos adequadamente estamos a enviar um sinal ao nosso corpo para a criação de um ambiente anabólico, um ambiente que potencia a libertação de factores de crescimento e que suprime a apoptose. Ou seja, o treino de força é um factor de crescimento macroscópico que suprime a morte programada das células (i.e. apoptose) mas ao contrário dos medicamentos em que o aumento na dose significa mais doença e dependência, um aumento na carga (mesmo que reduzido) significa mais saúde, mais força e mais vigor. Desta forma, as decisões diárias caberão sempre a cada um: tratar o corpo como um Ferrari ou tratar o corpo como um carro de aluguer.
Pedro Correia
Referências:
- Cruz-Jentoft AJ, Baeyens JP, Bauer JM et al. Sarcopenia: European consensus on definition and diagnosis: report of the European working group on sarcopenia in older people. Age Ageing 2010; 39: 412–23.
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, Cooper C, Landi F, Rolland Y, Sayer AA, Schneider SM, Sieber CC, Topinkova E, Vandewoude M, Visser M, Zamboni M; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019 Jan 1;48(1):16-31.
- Bischoff-Ferrari HA, Orav JE, Kanis JA et al. Comparative performance of current definitions of sarcopenia against the prospective incidence of falls among community-dwelling seniors age 65 and older. Osteoporos Int 2015; 26:2793–802.
- Schaap LA, van Schoor NM, Lips P et al. Associations of sarcopenia definitions, and their components, with the incidence of recurrent falling and fractures: the longitudinal aging study Amsterdam. J Gerontol A Biol Sci Med Sci 2018; 73: 1199–204.
- Malmstrom TK, Miller DK, Simonsick EM et al. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle 2016; 7: 28–36.
- Bahat G, Ilhan B. Sarcopenia and the cardiometabolic syndrome: a narrative review. Eur Geriatr Med 2016; 6: 220–23.
- Bone AE, Hepgul N, Kon S et al. Sarcopenia and frailty in chronic respiratory disease. Chron Respir Dis 2017; 14: 85–99.
- Chang KV, Hsu TH, Wu WT et al. Association between sarcopenia and cognitive impairment: a systematic review and metaanalysis. J Am Med Dir Assoc 2016; 17: 1164.e7–64.e15.
- Beaudart C, Biver E, Reginster JY et al. Validation of the SarQoL(R), a specific health-related quality of life questionnaire for Sarcopenia. J Cachexia Sarcopenia Muscle 2017; 8: 238–44.
- Dos Santos L, Cyrino ES, Antunes M et al. Sarcopenia and physical independence in older adults: the independent and synergic role of muscle mass and muscle function. J Cachexia Sarcopenia Muscle 2017; 8: 245–50.
- Akune T, Muraki S, Oka H et al. Incidence of certified need of care in the long-term care insurance system and its risk factors in the elderly of Japanese population-based cohorts: the ROAD study. Geriatr Gerontol Int 2014; 14: 695–701.
- Steffl M, Bohannon RW, Sontakova L et al. Relationship between sarcopenia and physical activity in older people: a systematic review and meta-analysis. Clin Interv Aging 2017; 12: 835–45.
- De Buyser SL, Petrovic M, Taes YE et al. Validation of the FNIH sarcopenia criteria and SOF frailty index as predictors of long-term mortality in ambulatory older men. Age Ageing 2016; 45: 602–8.
- Janssen I, Shepard DS, Katzmarzyk PT, Roubenoff R. The healthcare costs of sarcopenia in the United States. J Am Geriatr Soc. 2004 Jan;52(1):80-5.
- Sousa AS, Guerra RS, Fonseca I, Pichel F, Ferreira S, Amaral TF. Financial impact of sarcopenia on hospitalization costs. Eur J Clin Nutr. 2016 Sep;70(9):1046-51. doi: 10.1038/ejcn.2016.73. Epub 2016 May 11.
- Pinedo Villanueva, R. A., Westbury, L. D., Syddall, H. E., Sanchez, M., Dennison, E. M., Robinson, S. M., & Cooper, C. (2018). Health care costs associated with muscle weakness: a UK population-based estimate. Calcified Tissue International.
- Ruiz JR, Sui X, Lobelo F, et al. Association between muscular strength and mortality in men: prospective cohort study. BMJ. 2008;337(7661):a439. Published. doi:10.1136/bmj.a439.
- Srikanthan P, Karlamangla AS. Muscle mass index as a predictor of longevity in older adults. Am J Med. 2014;127(6):547-53.
- Dos Santos L, Cyrino ES, Antunes M, Santos DA, Sardinha LB. Changes in phase angle and body composition induced by resistance training in older women. Eur J Clin Nutr. 2016 Dec;70(12):1408-1413. doi: 10.1038/ejcn.2016.124. Epub 2016 Jul 13. PubMed PMID: 27406159.
- Cadore EL, Izquierdo M. Muscle Power Training: A Hallmark for Muscle Function Retaining in Frail Clinical Setting. J Am Med Dir Assoc. 2018 Mar;19(3):190-192.
Com o objectivo de melhorar as qualidades físicas de atletas, os autores são unânimes em afirmar que a força deverá ser vista como fundamental para a melhoria das restantes qualidades atléticas.
Como veremos ao longo do artigo, é considerado crucial tornar os atletas cada vez mais fortes, de forma a observar-se evolução no seu desenvolvimento atlético.
As diversas manifestações de força (força rápida e força de resistência) são influenciadas pela componente base, a força máxima, que é a capacidade do sistema neuromuscular produzir força contra uma resistência inamovível, independentemente do factor tempo (Mil-Homens et al, 2015).
A força muscular influencia as características força-tempo, que são importantes no desempenho desportivo pois, atletas mais fortes, apresentam mais força explosiva e taxa de produção de força. Ainda, segundo Suchomel et al. (2016), a capacidade de gerar força está directamente relacionada com a competência nas acções de potência muscular.
A força também influencia as acções desportivas relacionadas com a performance desportiva. Ser forte, implica conseguir efectuar acções de potência durante mais tempo e com intervalos menores de recuperação. Está directamente relacionada com a redução do número de lesões, devido à melhoria da qualidade nos ligamentos, tendões, cartilagens e tecido conjuntivo.
Influencia também a força relativa, que é o valor de força produzido por um atleta por unidade de massa corporal. Este conceito é fundamental em desportos nos quais os atletas têm de movimentar toda a sua massa corporal e competir por categorias de peso (Mil-Homens et al. 2015; Suchomel et al. 2016).
Por fim, a força também contribui para a melhoria das habilidades motoras gerais, como por exemplo, o salto, a corrida e as mudanças rápidas de direcção.
Pedro Ribeiro
(Artigo redigido no âmbito da prelecção “Treino Físico e Performance” no 9º Seminário – Desporto, Saúde e Cidadania, Março 2019.)
Bibliografia
- Bompa, T. O. & Haff, G. G. (2009). Periodization: Theory and Methodology of Training (5th). Human Kinetics.
- Joyce, D. & Lewindon, D. (Eds.) (2014). High Performance Training for Sports. Human Kinetics
- Mil-Homens, P., Correia, P. P. & Mendonça, G. V. (Eds). (2015). Treino de Força, Volume 1: Princípios Biológicos e Métodos de Treino. FMH Edições.
- Raposo, A. V. (2005). A Força no Treino com Jovens: Na Escola e no Clube.
- Suchomel, T. J., Nimphius, S. & Stone, M. H. (2016). The Importance of Muscular Strength in Athletic Performance. Sports Med, 46, 1419–1449. doi: 10.1007/s40279-016-0486-0.
Existe atualmente evidência científica suficiente para afirmarmos que o treino de força é um método eficaz ao nível da prevenção, tratamento e, potencialmente, da reversão de várias doenças crónicas. Efectivamente, a adesão a um programa de treino de força devidamente desenhado pode aumentar de forma significativa a saúde física e mental da população.
A importância é tal que são várias as organizações de renome mundial (Organização Mundial de Saúde, Centers for Disease Control and Prevention, American Heart Association, American Association for Cardiovascular and Pulmonary Rehabilitation, American College of Sports Medicine) que recomendam esta forma de treino para manter a saúde.
No entanto, apesar desta evidência, a maior parte da referenciação para o exercício é ainda o treino aeróbio e são poucos os médicos (e profissionais de saúde em geral) que fazem a referenciação para o treino de força. Este artigo tem como objectivo alertar para a relevância e para o impacto valioso do treino de força na saúde.
Cerca de 100% da nossa existência biológica tem sido dominada pela actividade outdoor. Caçar e procurar comida tem sido uma condição da vida humana durante milhões de anos1. Ou seja, se no passado era preciso fazer esforço (i.e. actividade física) para encontrar comida hoje em dia a comida vem ter connosco sem ter que fazermos esforço nenhum. Portanto, passamos de um estilo de vida bastante activo para um estilo de vida altamente sedentário. Com consequências graves ao nível da saúde pública. Se antigamente todas as pessoas tinham que exercer algum esforço físico para fazer a sua vida normal hoje em dia a maior parte não tem essas necessidades. O ambiente mudou e as pessoas também mudaram. Estão mais fracas, mais doentes, têm mais dores crónicas e estão cada vez mais dependentes de medicamentos. Mas a mensagem que ainda se passa na nossa sociedade (e em consultas médicas) é “não faça esforços e faça a sua vida normal”. E eu acredito que este é o pior conselho que se pode dar às pessoas! A vida normal? Mas que conselho é este? Como é que o normal pode ser bom? É preciso estar completamente alienado da realidade para poder fazer recomendações deste género.
Hoje em dia temos mais oportunidades do que nunca para construir um fenótipo saudável e forte. O fenótipo é a expressão do nosso organismo e este, depende em grande parte, das escolhas que fazemos todos os dias. Dois organismos podem ter o mesmo genótipo, o mesmo DNA, mas diferentes fenótipos – baseado nas suas experiências e no ambiente. É certo que há coisas que não conseguimos controlar como a nossa herança genética, o local do Mundo onde nascemos / vivemos, a sorte e o ambiente. Mas há muitas coisas que conseguimos controlar e que depende exclusivamente das nossas prioridades na vida e das nossas escolhas diárias (exemplos: hábitos de exercício, alimentação, sono, gestão do stress, tabagismo, álcool, exposição a ambientes poluídos). E eu acredito que o exercício físico em geral (e o treino de força em particular) é o factor mais importante de todos. É o mais potente, é quantificável e actua rapidamente em todos os sistemas e orgãos do corpo humano.
A realidade é esta: a população está envelhecida e com mais doenças crónicas / não transmissíveis. As principais doenças não transmissíveis são as doenças cardiovasculares, cancros, doenças respiratórias crónicas e diabetes. Só estes quatro grupos de doenças contam mais de 80% para as 41 milhões de mortes no Mundo2! De acordo com o primeiro relatório sobre envelhecimento saudável da Organização Mundial de Saúde (OMS) espera-se que o número de pessoas com mais de 60 anos duplique em 20503 e é neste contexto que precisamos de intervir com urgência no sentido de promover a autonomia motora e melhorar a capacidade funcional das pessoas. As tradicionais recomendações das caminhadas, da natação, do Pilates e de “fazer esforços de baixa intensidade” ou “não fazer esforços” provavelmente precisam de ser reconsideradas e devidamente contextualizadas.
É neste âmbito que o treino de força e o treino das qualidades físicas assumem um papel lapidar. Todas as pessoas (atletas e não atletas) precisam de treinar as suas qualidades físicas para viver com qualidade e de forma independente. Depois dos 30 anos de idade, os adultos perdem 3-8% da sua massa muscular por cada década. Ao longo do tempo, a perda de massa magra contribui para uma diminuição da força muscular e da potência, importantes preditores de equilíbrio, da ocorrência de quedas e de mortalidade4. No caso dos idosos é importante assinalar que as quedas são a principal causa de morte acidental após os 65 anos e são as fracturas das ancas aquelas que afectam em maior extensão a independência dos mesmos5.
Quando falo em força refiro-me à base para interagirmos com o ambiente à nossa volta, à fundação para o desenvolvimento das outras qualidades físicas (mobilidade, potência, velocidade, agilidade, endurance muscular), à capacidade de produzir força contra uma resistência externa (pode ser o chão ou outro objecto qualquer) através das contracções musculares. Esta é, provavelmente, a capacidade mais treinável que dispomos e aquela que poderá ter maiores repercussões na melhoria da nossa função, na nossa independência e na nossa longevidade funcional. Tarefas como caminhar rapidamente, sentar e levantar de uma cadeira, subir escadas, manter o equilíbrio, carregar malas ou brincar com os filhos / netos, são exemplos de actividades da nossa vida diária que requerem uma componente mínima das várias manifestações de força (força máxima, força rápida e força de resistência). Portanto, tanto a força como o músculo (mais a sua qualidade que quantidade), são parâmetros da função física que precisam de ser cuidados na construção do fenótipo do envelhecimento saudável.
Estas questões assumem maior importância ainda quando constatamos que a partir do passado dia 1 de Outubro de 2016, na décima revisão da classificação internacional de doenças (ICD-10), a sarcopenia foi classificada como uma doença pela OMS sendo detentora de um código próprio (M62.84). Isto deverá levar a um aumento na disponibilidade de ferramentas de diagnóstico e a um maior entusiasmo da indústria farmacêutica para desenvolver medicamentos para combater a sarcopenia6. Mas na minha opinião isto também representa uma grande oportunidade para os profissionais do exercício poderem ajudar no combate desta doença, já que será o treino de força (devidamente orientado como é óbvio) o estímulo mais potente na sua prevenção e tratamento.
Pedro Correia
Referências:
- Booth FW, Roberts CK, Laye MJ. Lack of exercise is a major cause of chronic diseases. Comprehensive Physiology. 2012;2(2):1143-1211. doi:10.1002/cphy.c110025.
- GBD 2015 Risk Factors Collaborators. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet, 2016; 388(10053):1659-1724.
- Beard JR, Officer A, de Carvalho IA, et al. The world report on ageing and health: A policy framework for healthy ageing. Lancet 2016;387:2145e2154.
- English KL, Paddon-Jones D. Protecting muscle mass and function in older adults during bed rest. Current Opinion in Clinical Nutrition and Metabolic Care. 2010;13(1):34-39. doi:10.1097/MCO.0b013e328333aa66.
- National Center for Injury Prevention and Control of the Centers for Disease Control and Prevention. Preventing Falls: A Guide to Implementing Effective Community-Based Fall Prevention Programs 2nd edition. Atlanta: 2015.
- Anker SD, Morley JE, von Haehling S. Welcome to the ICD-10 code for sarcopenia. J Cachexia Sarcopenia Muscle. 2016 Dec;7(5):512-514. Epub 2016 Oct 17. PubMed PMID: 27891296; PubMed Central PMCID: PMC5114626.
Nos artigos anteriores desta série (ver aqui Parte 1 e Parte 2) discutimos o fato de que enquanto todos os golfistas vão fazer todos os possíveis para alterar o seu jogo (comprando tacos novos e bolas novas), muitos negligenciam um dos fatores mais decisivos para o seu sucesso físico e mental – a sua nutrição; identificamos algumas das principais razões pelas quais os golfistas nunca mudam e, finalmente, indicamos cinco ligações importantes entre o golfe e uma alimentação adequada. Neste artigo vou partilhar consigo as minhas preocupações sobre a dieta normal e os cinco hábitos mais importantes que deve criar para começar a nutrir melhor o seu corpo.
A Dieta Ocidental
A dieta ocidental é geralmente utilizada para descrever os hábitos alimentares popularizados nos EUA. Como esses hábitos alimentares são ainda muito populares na Europa e outras partes do mundo não-ocidental, provavelmente será necessário encontrar um novo nome para este tipo de “alimentação” nos próximos anos (talvez a dieta assassina seja um bom nome!).
Mas o que é a “dieta ocidental?” Bem, esta “dieta” pode ser resumidamente caraterizada por uma ingestão elevada de alimentos processados, hidratos de carbono refinados, açúcar e de gorduras hidrogenadas; e por uma baixa ingestão de frutas, verduras e gorduras saudáveis. É esta “dieta ocidental” que tem sido associada à maioria das doenças ocidentais ou doenças da civilização (exemplos: doenças cardiovasculares, obesidade, diabetes, cancro, alzheimer, parkinson). Curiosamente, esta dieta também pode ser a responsável pelo aumento da violência e pela diminuição dos resultados dos testes cognitivos nas crianças em idade escolar (défice de atenção) e nos adultos. Finalmente, esta “dieta ocidental” também tem sido associada à perda de massa óssea (osteoporose) e à diminuição de massa muscular (sarcopenia) em indivíduos adultos.
Vamos ver um exemplo de um menu diário de um “atleta normal” antes de trabalhar comigo.
Pequeno Almoço: Taça de cereais com leite + sumo de laranja natural + café com açúcar
Snack 1: Tosta mista + leite achocolatado
Almoço: Salada de frango com molho de maionese e ketchup + refrigerante + gelado
Snack 2: Fatia de bolo + sumo
Jantar: Peixe grelhado com verduras + batatas assadas + copo de vinho tinto + sobremesa
Para a maior parte das pessoas, isto até pode ser considerado um dia bom (e, de fato, há algumas coisas boas neste menu) mas no longo prazo este tipo de alimentação vai comprometer e muito a sua saúde e performance. Por este motivo há que discutir esta situação com a pessoa e atender às suas reais necessidades fisiológicas e funcionais.
Os Hábitos que deve criar
Antes de proceder à alteração da dieta, para mim o mais importante é que as pessoas comecem com uma base firme e sólida para, depois, efetuarem as mudanças necessárias para a otmização da sua saúde e performance. A maior parte das pessoas (atletas incluídos) quer começar a construir uma casa pelo telhado ou pelas paredes sem atender à qualidade do solo. Qualquer um destes hábitos são bastante simples, mas tal como qualquer hábito que pretenda criar, é preciso tempo de prática para assimilar as bases de uma nutrição correta.
Hábito 1 – Beber mais água
Por vezes falamos de tanta coisa no que diz respeito à alimentação e esquecemo-nos da água, o elemento mais importante que o nosso corpo precisa para funcionar corretamente. É a água que regula todas as funções do nosso corpo, incluindo a atividade de todos os solutos (os materiais sólidos) dissolvidos na mesma, ou seja, é a água, em primeiro lugar, que vai permitir que os nutrientes que consumimos cheguem às nossas células e aos nossos orgãos. Aponte para consumir 1-2 copos de água após acordar e para beber cerca de 2 litros/dia.
Hábito 2 – Comer uma fonte de proteína em todas as refeições
É fundamental comer proteína em cada refeição. Claro, alguns “especialistas” vão fazê-lo(a) acreditar no contrário, sugerindo que a proteína é de alguma forma prejudicial aos rins, desnecessária, etc. No entanto, eu quero destacar o fato que aquilo que procuro para os meus clientes/atletas é o melhor destes três mundos: melhor saúde, melhor corpo e melhor performance – será muito difícil alcançar estes três com uma ingestão sub-ótima de proteína. Alguns exemplos incluem: ovos, carne, peixe, frango, peru e marisco.
Hábito 3 – Comer verduras em todas as refeições
Os seus pais e/ou avós têm razão – você precisa de comer verduras para prevenir doenças! A evidência tem demonstrado que, para além dos micronutrientes (vitaminas e minerais) presentes nas verduras, há também fitoquímicos que são essenciais para o nosso funcionamento fisiológico ideal. As verduras vão ajudar a melhorar o equilíbrio ácido-base no corpo por isso o meu conselho todas as verduras que puder!
Hábito 4 – Comer uma fonte de gordura saudável em cada refeição
A gordura (tal como a proteína) é um macronutriente essencial e por esse motivo temos que garantir um aporte adequado todos os dias através da nossa dieta. Tem havido muita confusão em relação aos efeitos da gordura na dieta mas a verdade é que a gordura pode ser a nossa melhor amiga quando o objetivo é perder massa gorda, otimizar a resposta fisiológica do nosso corpo e a nossa saúde. Alguns exemplos de gordura saudável incluem: peixe gordo, oleaginosas, azeite virgem extra, côco e pêra abacate.
Hábito 5 – Comer mais verduras com as refeições principais e deixar os outros hidratos de carbono para a janela pós-treino
Outra forma de dizer isto é: se você tem gordura para perder, você tem que ganhar o direito a comer hidratos de carbono, fazendo exercício físico vigoroso em primeiro lugar! Quer continuar a comer pão, massa, arroz, batata, bolachas, alimentos açucarados, pizzas, doces, etc.? Você até pode comê-los – apenas tenha a certeza que o faz na janela pós treino (1-2 horas após o treino) porque esta é a altura que o seu corpo está mais sensível à insulina. Quanto à qualidade dos hidratos de carbono, terá mais benefícios se optar por alimentos sem glúten (arroz, quinoa, castanhas, batata-doce, inhame, batata) que pelos alimentos excessivamente processados e/ou com glúten – não aproveite o fato de fazer exercício para tratar o seu corpo como se fosse o camião do lixo!
Votos de um Bom Natal e Feliz Ano Novo!
Pedro Correia
Todos os jogadores de golfe têm uma característica em comum: eles vão investir bastante tempo e dinheiro para melhorar o seu jogo! Eles vão contratar os melhores treinadores para aperfeiçoar o seu swing de golfe. Eles vão comprar o melhor equipamento disponível para obter mais precisão e ganhar distância. Aqueles que já perceberam a importância da preparação física nesta modalidade vão contratar os melhores profissionais para ajudá-los a ganhar mobilidade, a ficar mais fortes e com maior resistência física. Alguns vão recorrer aos psicólogos desportivos para aprender como manter uma boa atitude em campo, o foco e a concentração. Eles fazem tudo isto com o objetivo de fazer mais birdies. Mas será que eles não se estão a esquecer de nada?
No meio de tudo isto há algo que a maioria dos golfistas se esquece de alterar: a sua dieta de baixa qualidade. A maioria dos golfistas não faz a mínima ideia de como é que a dieta pode influenciar a performance. Para começar, eles esquecem-se que comer mal vai comprometer o aumento de força muscular e vai levar à acumulação de gordura corporal. E se você ainda pensa que ter músculos fracos e excesso de gordura corporal é o caminho a seguir para tornar-se um golfista de alto nível, nem vale a pena continuar a ler. Este artigo não é para si.
Além dos efeitos na composição corporal e no défice de força muscular é preciso ter em conta que comer mal vai limitar o foco e concentração, vai levar a alterações de humor e pode levar a uma má função imunológica, a um aumento da inflamação crónica e a problemas de saúde em geral. Experimente jogar várias rondas durante dias seguidos quando está de mau humor, em má forma física, e não se consegue concentrar. Uma nutrição de má qualidade vai ter um impacto directo nos treinos e na competição. A falta de foco, de concentração e o cansaço precoce, especialmente durante os treinos e/ou competições, são sinais que a sua nutrição está a comprometer a sua performance.
Não tenha dúvidas: você até pode ser muito habilidoso com os tacos, fazer uns shots à Ballesteros e fazer umas rondas excepcionais de vez em quando, mas se aquilo que você procura é consistência nos resultados e longevidade enquanto golfista, não há nenhum substituto melhor que os alimentos que você come todos os dias. Nenhum!
Então porquê que os golfistas nunca mudam?
Existem várias razões pelas quais os golfistas nunca mudam e preferem continuar a comer as club sandwiches, as batatas fritas e os pratos de massa que existem em todos os clubhouses do Mundo. Vamos ver algumas.
1) O mito da refeição pré-competição.
Muitos golfistas (especialmente os principiantes) cometem o erro de pensar que são apenas os alimentos comidos antes e durante os treinos e jogos que podem afectar o seu jogo. Embora isto possa fazer sentido à primeira vista, não é isso que acontece do ponto de vista fisiológico – a maior parte da energia que você está a utilizar hoje depende dos nutrientes que comeu (e absorveu) nas últimas 72 horas!
Atenção, eu não estou a dizer que aquilo que você come antes e depois dos treinos/competições não faz diferença. É claro que faz! No entanto, essas refeições não são necessariamente as mais importantes. Cada refeição vai ter um determinado impacto no seu corpo independentemente do espaço temporal em que a mesma é consumida. É o efeito cumulativo dessas refeições que vão levar a uma melhoria (ou diminuição) da performance.
Por outras palavras, no golfe, não há nenhuma refeição mágica pré-competição ou intra-competição. Se você esperou até o dia antes de uma grande competição para começar a comer bem, é bem provável que já seja tarde demais. Lamento informar mas não há soluções milagrosas, você precisa mesmo de comer bem de forma consistente!
2) Os golfistas não conseguem ver a ligação entre a nutrição e a performance.
A maioria dos golfistas não percebe a lógica entre a nutrição e a performance. E isso acontece porque eles não estão conscientes de como é que a alimentação vai influenciar a sua função muscular e a bioquímica do cérebro.
No caso do golfe, como esta é uma modalidade que não envolve um dispêndio energético muito grande e que não obriga os atletas a manter um certo peso corporal (como acontece com os lutadores, ginastas, nadadores, atletas de endurance ou atletas de outros desportos), pensa-se que a necessidade de comer bem não é assim tão importante. Ou seja, não é assim tão óbvia essa relação.
Mas a questão fundamental não é essa, não é preciso que os golfistas sejam indivíduos musculados e com baixa percentagem de gordura corporal como você vê nas revistas de fitness. Aquilo que eles precisam é de desenvolver o seu potencial atlético para este não ser um factor que possa prejudicar a sua performance no campo de golfe. O golfe não é um desporto muito intenso do ponto de vista energético pelo que as necessidades nutricionais de um golfista não podem ser iguais às de um lutador ou de um atleta de endurance. Mas diferentes não significa menos importantes – como vimos acima não é apenas a composição corporal que vai ser influenciada pela alimentação.
Apesar da ligação entre o golfe e a nutrição ser um pouco menos visível que nos outros desportos, ela existe. A manutenção e/ou aumento da massa muscular, os ganhos de mobilidade, a redução da inflamação dos músculos e articulações, a manutenção do foco e concentração, a prevenção de lesões, todos estes aspectos podem ser influenciados pela nutrição. Mas só aqueles que colocarem as melhores estratégias nutricionais em prática é que terão vantagens competitivas (é óbvio que isto não inlcui Big Macs!).
3) A dificuldade em mudar os hábitos alimentares.
Provavelmente o obstáculo mais difícil para a maioria das pessoas é superar os hábitos alimentares que têm. Os nossos padrões alimentares já existem há muito tempo e são poucas as pessoas que estão dispostas a mudá-los se não houver uma razão muito forte para tal (como no caso de um problema grave de saúde). E porquê que isso acontece? Porque nós não fomos ensinados a pensar que os alimentos são informação para as nossas células. Nós não fomos ensinados a pensar que os alimentos vão influenciar a expressão dos nossos genes. Nós não fomos ensinados a pensar que são os alimentos que consumimos os gatilhos ambientais que vão contribuir para a melhoria da saúde ou para a sua deterioração.
É claro que existem muitas outras razões que explicam a relutância dos golfistas para mudar os seus hábitos alimentares e que explicam porquê que você não muda os seus. E é por esse motivo que no próximo artigo vou continuar a abordar este tema para você perceber porquê que precisa de mudar os seus hábitos alimentares rapidamente para viver com mais saúde e para poder levar o seu jogo para o próximo nível.
Bons treinos!
Pedro Correia
Para manterem a função física, recuperarem melhor de lesões, manterem massa magra e manterem-se mais saudáveis de um modo geral, indivíduos mais velhos necessitam de uma maior ingestão de proteína do que indivíduos jovens. Uma ingestão maior de proteína contribui para atenuar processos inflamatórios e catabólicos, bem como o decréscimo de eficiência no metabolismo da proteína associado com a idade.
De acordo com as recomendações avançadas pelo PROT-AGE Study Group (2013) (referência abaixo), indivíduos mais velhos deverão:
– ingerir PELO MENOS 1 a 1.2 g/kg de peso corporal de proteína por dia;
– ingerir AINDA MAIS se sofrem de doenças agudas ou crónicas, entre 1.2-1.5 g/kg de peso corporal de proteína por dia;
– ingerir AINDA MAIS se se encontram sub-nutridos e/ou sofrem duma doença ou lesão severa, ~2g/kg de peso corporal de proteína por dia;
– limitar a ingestão de proteína se sofrem de DOENÇA RENAL SEVERA E NÃO ESTÃO EM HEMODIÁLISE, sendo portanto UMA EXCEPÇÃO. E não, a doença renal NÃO é provocada pela ingestão de proteína;
– usar suplementação para atingir os níveis de ingestão de proteína desejados;
– E, claro, FAZER EXERCÍCIO que promova de forma mais eficaz a manutenção ou incremento de massa magra, ou seja, treino de força.
E não, a doença renal NÃO é causada pela ingestão de proteínas. Num estudo em que se acompanhou durante o período de um ano homens treinados em treino de força que consumiam ~2,51-3,32g/kg de peso corporal por dia durante um ano, não se verificou quaisquer efeitos prejudiciais no perfil lipídico de no sangue, bem como nas funções hepática e renal (Antonio et al, 2016).
A manutenção de força e massa magra (inclui massa muscular, massa óssea e do tecido conjuntivo) estão identificados como os primeiros e mais relevantes biomarcadores de saúde e longevidade. A melhoria destes marcadores produz um “efeito dominó” positivo e poderoso na grande parte (provavelmente todos) dos outros marcadores de saúde. A ingestão adequada de proteína e treino de força é essencial para construção de massa magra. E ainda mais determinante à medida que envelhecemos para contrapor a inevitável perda progressiva de eficiência no nosso metabolismo.
Não receie a proteína nem o treino de força. Estes são, provavelmente, dois dos seus melhores aliados para viver melhor e mais tempo.
Bom almoço e não se esqueça da proteína!
Nuno Correia
Referências:
Bauer, J. et al., 2013. Evidence-based recommendations for optimal dietary protein intake in older people: A position paper from the prot-age study group. Journal of the American Medical Directors Association, 14(8), pp.542–559.
Antonio, J., Ellerbroek, A., Silver, T., Vargas, L., Tamayo, A., Buehn, R., & Peacock, C. A. (2016). A High Protein Diet Has No Harmful Effects: A One-Year Crossover Study in Resistance-Trained Males. Journal of nutrition and metabolism, 2016, 9104792.
Recentemente, a International Society of Sports Nutrition publicou um “position stand” (ver referência abaixo) acerca da segurança e eficácia da suplementação com creatina no contexto do exercício, desporto e medicina.
A suplementação com creatina, um dos mais populares e estudados suplementos nutricionais, tem de facto mostrado ser eficaz em melhorar a performance atlética (sobretudo em exercício de alta intensidade) e induzir adaptações ao treino relevantes. O aumento consequente das reservas intra-musculares de creatina (e fosfocreatina) facilita a resíntese rápida de ATP (“moeda de troca” energética essencial para quase todas as reacções no nosso corpo) e dessa forma contribui para melhorar a performance porque aumenta a capacidade de produção de força, trabalho muscular, acelera a recuperação e parece contribuir para prevenir lesões.
Contudo, a suplementação com creatina parece ser altamente segura e eficaz em atletas, não-atletas (entusiastas do exercício físico) e ainda em várias populações clínicas. De facto, vários estudos (ver artigo da ISSN, referência abaixo) apontam para benefícios na suplementação com creatina nas mais variadas populações e contextos clínicos, tais como:
– Acelerar a reabilitação de lesões (porque atenua a atrofia muscular);
– Protecção de lesões neuronais (medulares e cerebrais);
– Atenuar as consequências debilitantes em pessoas com síndromas congénitos de deficiência de síntese de creatina;
– Atenuar a progressão de doenças neurodegenerativas (e.g. doença de Huntington, doença de Parkinson, doenças mitocondriais, esclerose lateral amiotrófica);
– Prevenir e/ou melhorar a bioenergética em pacientes com isquemia do miocárdio ou vítimas de acidente vascular cerebral;
– Melhorar indicadores metabólicos e funcionais associados ao envelhecinento;
– Possível benefício durante a gravidez para o óptimo crescimento, desenvolvimento e saúde do feto.
Em conclusão, a creatina parece de facto ser um suplemento nutricional seguro e com benefícios para as mais variadas populações e idades.
Nuno Correia
Referências:
Kreider, R.B. et al., 2017. International Society of Sports Nutrition position stand: safety and efficacy of creatine supplementation in exercise, sport, and medicine. Journal of the International Society of Sports Nutrition, 14(1), p.18.
PODERÁ A RESTRIÇÃO CALÓRICA OU O JEJUM INTERMITENTE CONTRIBUIR PARA EVITAR “DOENÇAS DA IDADE” E VIVER MAIS TEMPO? – PARTE 3
Veja aqui a parte 1 e a parte 2
Implicações e aplicações práticas da restrição calórica e jejum intermitente
E agora…será que a prática de restrição calórica (RC) ou jejum pode ter valor terapêutico em humanos?
Como foi referido anteriormente (parte 1), estudos randomizados e controlados em humanos a estudar os efeitos da RC e jejum em humanos são mais escassos. Não é fácil encontrar voluntários para se sujeitarem ao “desconforto” de ingerir menos comida.
Só um aparte…
Diga-se de passagem que mudar o que quer que seja na alimentação de alguém pode ser uma tarefa difícil! De facto, e baseado na minha experiência, as pessoas são em geral altamente resistentes em mudar seja o que for nos seus padrões alimentares e tendem a defendê-los com “unhas e dentes”! Elaboram os mais variados racionais (e muito sofisticados por vezes…como o típico “mas o meu avô tem 90 anos e sempre comeu isto ou aquilo”) para simplesmente justificar a ingestão deste ou aquele alimento que no fundo “apenas” gostam de ingerir. A nutrição é para alguns uma religião, acreditem…!
Voltando aos estudos com humanos…
A outra razão prática para o facto de haver escassez de estudos controlados e randomizados em humanos sobre os efeitos da RC ou jejum para estudar os seus efeitos na esperança de vida e a incidência de “doenças da idade” prende-se com o facto da esperança de vida humana ser longa.
Contudo, alguns estudos randomizados e controlados em humanos apontam para benefícios claros da prática de RC em determinadas populações. Seguidamente estão resumidos alguns desses estudos, tipo de intervenção e efeitos significativos verificados.
- Wang et al. (2013)
- Amostra: indivíduos obesos.
- Intervenção: 5 dias de 30% de RC (low-fat/high-carb ou high-fat/low-carb) após período de dieta isocalórica.
- Resultados significativos:
- As dietas de RC desceram os níveis de insulina e leptina em jejum aumentando os níveis de ácidos gordos livres (o que indica mobilização das reservas de gordura);
- Sensibilidade à insulina não melhorou significativamente (talvez devido ao curto período de 5 dias), contudo a sinalização de insulina no músculo (em resposta à insulina) aumentou apenas dos sujeitos na dieta low-fat/high-carb. Atenção que este efeito na sinalização de insulina em resposta à dieta low-fat/high-carb (e não na dieta high-fat/low-carb) pode representar apenas uma resposta adaptativa transiente devido à maior carga glicémica da dieta. A duração curta do estudo não permite concluir uma melhoria sustentada na regulação de insulina.
- Kitzman et al. (2016)
- Amostra: indivíduos obesos e idosos (67±5 anos) com insuficiência cardíaca.
- Intervenção: 20 semanas de RC (défice de 350-400kcal/dia) com ou sem exercício (1 hora de caminhada 3 dias por/semana).
- Resultados significativos:
- Tanto a RC como o exercício (separadamente) incrementaram a capacidade aeróbia (indicado pelo aumentos de VO2 pico), com efeitos ainda maiores se combinados;
- Tanto a RC como o exercício (separadamente) melhoraram a composição corporal (perda de massa gorda) com efeitos ainda maiores se combinados;
- A RC (mas não o exercício) reduziu o marcador inflamatório proteína C reactiva (CRP) e estava correlacionada com a perda de peso.
- Snel et al. (2012)
- Amostra: indivíduos obesos com diabetes mellitus tipo 2 (T2DM) e insulino-dependentes.
- Intervenção: 16 semanas de RC (450kcal/dia) com ou sem exercício (1 hora + 4 sessões de 30 minutos num cilcloergómetro por semana).
- Resultados significativos:
- Tanto a RC como o exercício melhoraram os níveis de glucose, insulina e hemoblogina glicosilada (HbA1c) em jejum;
- O grupo RC + exercício perdeu mais gordura e perímetro na cintura em comparação ao grupo apenas em RC;
- Tanto a RC como o exercício aumentaram a expressão dos receptores e sinalização de insulina (revelado por biópsia muscular) bem como a sensibilidade periférica à insulina.
- Pedersen et al. (2015)
- Amostra: indivíduos com sobrepeso ou obesos, não diabéticos com doença das artérias coronárias.
- Intervenção: 12 semanas de RC (800-1000kcal/day) com ou sem exercício (treno aeróbio intervalado 3 dias/semana).
- Resultados significativos:
- Separadamente, a RC foi superior ao exercício na perda de peso corporal, massa gorda e perímetro na cintura, bem como glicémia em jejum, sensibilidade à insulina e tolerância à glucose. Contudo, a RC conduziu a melhores resultados quando combinado com o programa de exercício.
- Razny et al. (2015)
- Amostra: indivíduos obesos não-diabéticos
- Intervenção: 3 meses de RC (1200-1500kcal/dia) com ou sem 1.8 g/dia de ácidos gordos omega-3 (num rácio de 5:1 de DHA/EPA).
- Resultados significativos:
- RC com ou sem suplementação com omega-3 resultou em decréscimo no peso corporal e massa gorda semelhantes;
- RC teve um efeito positivo superior nos níveis de triglicéridos e insulina qaundo combinado com suplementação com omega-3;
- RC + omega-3 (mas não apenas RC) melhorou indicadores de resistência à insulina (indíce HOMA).
- Prehn et al. (2016)
- Amostra: mulheres obesas em idade pós-menopausa.
- Intervenção: 12 semanas de RC (<800kcal/dia) seguido de 4 semanas numa dieta isocalórica ou 16 semanas duma dieta isocalórica (control group). Recomendação de aumentar a actividade física por semana.
- Resultados significativos:
- RC (mas não a dieta isocalórica) resultou em scores melhores em testes de performance de memória;
- RC (mas não a dieta isocalórica) resultou numa melhoria do controlo glicémico e dos níveis de HbA1c;
- O incremento na densidade na matéria cinzenta cerebral induzido pela RC revelou-se negativamente correlacionado com os níveis de glucose.
Recomendações e conclusões
De facto, intervenções de RC ou jejum parecem realmente ter clara utilidade terapêutica na melhoria de parâmetros de saúde relacionados com obesidade, inflamação, resistência à insulina, stress oxidativo e função cardíaca. É importante notar que apenas reduzir a quantidade de comida ingerida pode não ser suficiente e porventura pouco recomendável. Uma intervenção simplista desse género e prolongada no tempo pode resultar em défices nutricionais e por essa via boicotar resultados positivos para a saúde. Por isso, é importante monitorizar e garantir níveis adequados de nutrientes através de suplementação e/ou na escolha de alimentos nutricionalmente densos. De realçar também os efeitos sinérgicos positivos que a RC parece ter quando combinada com exercício (Snel et al., 2012; de Luis et al., 2015; Kitzman et al., 2016), podendo ser prescritos concomitantemente. Neste sentido, uma intervenção de RC muito ligeira (e.g. défice de 10%) ou um períodos de jejum intermitente curtos (>12 horas e não precisa de ser todos os dias) combinado com exercício poderá ter efeitos muito positivos e com eventual maior probabilidade de adesão do que intervenções de RC ou jejum mais agressivas.
Naturalmente, que RC severa, prolongada no tempo e sem exercício (especialmente treino de força) pode induzir perda de massa magra que é altamente indesejável se o objectivo é melhorar a saúde. Mais uma vez, e como em quase tudo, a dose correcta é o segredo! Em certas populações como grávidas (ou mulheres a tentar engravidar) e indivíduos jovens em crescimento, intervenções prolongadas de RC deverão ser evitadas pois podem comprometer o desenvolvimento. Contudo, volto a realçar que o mais determinante não é ingerir “calorias” mas sim ingerir “nutrientes”! Em indivíduos mais velhos com sarcopenia a RC deverá ser porventura evitada, embora os factores mais determinantes para inverter um quadro de sarcopenia são treino de força e ingestão adequada de proteína diária (que deve ser mais mais elevada para indivíduos mais velhos, >2g/kg de peso corporal).
Em relação ao caso específico do jejum intermitente (nota: o enfoque deste artigo não é discutir a utilização do jejum intermitente como estratégia de perda de gordura e/ou manutenção ou ganhos de massa muscular no contexto desportivo, mas sim os seus potenciais benefícios para a saúde geral), apesar dos poucos estudos controlados e randomizados em humanos, este parece oferecer efeitos positivos semelhantes aos da RC constante e será porventura mais fácil de implementar (Donati et al., 2008; Marzetti et al., 2009; Alirezaei et al., 2010; Arum et al.; 2014; Godar et al., 2015). Episódios pontuais de jejum (e.g. não tomar pequeno-almoço uma a duas vezes por semana em dias que não se treina por exemplo) não só poderá ser uma estratégia de fácil implementação para controlo semanal total de calorias ingeridas, como permite um efeito hormético positivo que é mediado por alguns dos mecanismos atrás descritos. O conceito de hormese é definido como um efeito benéfico na saúde, na resistência ao stress, no crescimento ou na longevidade – resultante da exposição a uma dose “adequada” a um agente stressor.
Em resumo, a RC ou jejum (ou o exercício) é algo para o qual estamos evolutivamente desenhados para tolerar e que na dose correcta oferece-nos benefícios e maior resiliência. Ou seja, o stress pontual de não comer pode ser um “desconforto saudável”!
Até à próxima!
Nuno Correia
Bibliografia e Referências
Alirezaei, M. et al., 2010. Short-term fasting induces profound neuronal autophagy. Autophagy, 6(6), pp.702–710.
Arum, O. et al., 2014. Preservation of blood glucose homeostasis in slow-senescing somatotrophism-deficient mice subjected to intermittent fasting begun at middle or old age. Age, 36(3), pp.1263–1290.
de Luis, D.A. et al., 2015. Response of osteocalcin and insulin resistance after a hypocaloric diet in obese patients. Eur Rev Med Pharmacol Sci. 19(12) pp.2174–2179.
Donati, A. et al., 2008. Effect of Aging and Anti-Aging Caloric Restriction on the Endocrine Regulation of Rat Liver Autophagy. Journal of Gerontology: BIOLOGICAL SIENCES, 63(6), pp.550–555.
Dröge W., 2009. Avoiding the First Cause of Death. New York, Bloomington. iUniverse, Inc.
Godar, R.J. et al., 2015. Repetitive stimulation of autophagy-lysosome machinery by intermittent fasting preconditions the myocardium to ischemia-reperfusion injury. Autophagy. 11(9), pp.1537-1560.
Kitzman, D.W. et al., 2016. Effect of Caloric Restriction or Aerobic Exercise Training on Peak Oxygen Consumption and Quality of Life in Obese Older Patients With Heart Failure With Preserved Ejection Fraction: A Randomized Clinical Trial. Jama, 315(1), pp.36–46.
Lindeberg, S., 2010. Food and Western Disease: Health and Nutrition from an Evolutionary Perspective. Oxford, United Kingdom: Wiley-Blackwell.
Marzetti, E. et al., 2009. Cellular mechanisms of cardioprotection by calorie restriction: state of the science and future perspectives. Clinics in Geriatric Medicine, 25(4), pp.715–732.
Masoro.E. L., 2002. Caloric Restriction: A Key to Understanding and Modulating Aging. Texas, USA: ELSEVIER.
Pedersen, L.R. et al., 2015. A randomized trial comparing the effect of weight loss and exercise training on insulin sensitivity and glucose metabolism in coronary artery disease. Metabolism: Clinical and Experimental, 64(10), pp.1298–1307.
Prehn, K. et al., 2016. Caloric Restriction in Older Adults—Differential Effects of Weight Loss and Reduced Weight on Brain Structure and Function. Cerebral Cortex in press, pp.1–14.
Razny, U. et al., 2015. Effect of caloric restriction with or without n-3 polyunsaturated fatty acids on insulin sensitivity in obese subjects: A randomized placebo controlled trial. BBA Clinical, 4, pp.7–13.
Snel, M. et al., 2012. Effects of adding exercise to a 16-week very low-calorie diet in obese, insulin-dependent type 2 diabetes mellitus patients. Journal of Clinical Endocrinology and Metabolism, 97(7), pp.2512–2520.
Wang, C. C. L., 2013. Insulin Signaling in Obese Individuals During Caloric Restriction. Metabolism, 62(4), pp.595–603.
PODERÁ A RESTRIÇÃO CALÓRICA OU O JEJUM INTERMITENTE CONTRIBUIR PARA EVITAR “DOENÇAS DA IDADE” E VIVER MAIS TEMPO? – PARTE 2
Veja aqui a parte 1
Que mecanismos subjazem aos efeitos da restrição calórica ou jejum intermitente na longevidade e “doenças da idade”?
Mas afinal o que é “envelhecer”…e porquê…?
Envelhecer tem sido caracterizado por vários autores como um processo de deterioração progressiva das estruturas e funções moleculares, celulares e dos tecidos que está condicionada por factores genéticos e ambientais (Hu & Liu, 2014). Este processo multifactorial e complexo torna o indivíduo mais vulnerável à doença e conduz, no último momento, à morte. As principais determinantes (resultante de predisposição genética e factores ambientais) que caracterizam o processo de envelhecimento ao nível celular têm sido apontadas como sendo: danos causados por radicais livres; disfunção mitocondrial que resulta numa acumulação de espécies reactivas de oxigénio (ROS) e consequente stress oxidativo; decréscimo e ineficiência da autofagia (um processo conservado evolutivamente de reciclagem e “limpeza” essencial para a integridade celular – detalhes mais à frente); alterações nos processos de sinalização relacionados com hormonas como o factor de crescimento semelhante à insulina tipo 1 (IGF-1), insulina e hormona do crescimento; alteração no metabolismo do colesterol e da glucose; encurtamento dos telómeros (Testa et al., 2014).
Ora, parece que o processo de envelhecimento é de facto multifactorial. Provavelmente as várias teorias de envelhecimento (parte 1) estão correctas! Em geral, os processos moleculares vão-se tornando mais ineficientes, lentos e o sistema vai caminhando progessivamente para a entropia. Contudo, parece que conhecer o processo de autofagia (cujo declínio está associado ao envelhecimento) pode oferecer uma “nova” perspectiva sobre o envelhecimento. Autofagia (ou “auto-digestão”) tem sido definido como um processo catabólico (normal e importante) que se caracteriza pela degradação nos lisossomas (organelo celular que funciona como “depósito de lixo”) de organelos danificados, proteínas “defeituosas” e patogénios intracelulares (Lavallard et al., 2012). A autofagia proporciona a degradação e reciclagem de macromoléculas, fornecendo não só novos nutrientes e energia durante restrição energética (durante restrição calórica ou jejum), mas também prevenindo a acumulação de resíduos celulares e agregados de proteínas no citoplasma. Logo, a autofagia constitui um processo protector e essencial para a homeostasia celular (Rubinsztein, Mariño & Kroemer, 2011) (nota: fiquem descansados os que pensam que a autofagia vai “comer os músculos todos” por ficarem umas horas sem comer. Isso não acontece!). De facto, vários autores têm apontado uma deficiente capacidade autofágica como um mediador importante de senescência celular e consequente ocorrência de “doenças ou características da idade” como: doenças cardiovasculares e neurodegenerativas; stress oxidativo; sistema imunitário débil; inflamação crónica; osteoporose; sarcopenia; diabetes; obesidade; cancro (Pallauf & Rimbach, 2013; Pyo, Yoo & Jung, 2013). Especificamente, revisões de estudos mecanicistas com animais têm indicado que a perda de função nos genes relacionados com a autofagia (autophagy-related genes – ATGs) resultaram na acumulação intracelular de proteínas e organelos defeituosos e consequentemente na aceleração do envelhecimento, enquanto que a promoção da actividade autofágica aumentou a esperança de vida (Yen & Klionsky 2008).
Nota: Os mecanismos de autofagia parecem realmente estar na ordem do dia com atribuição do Prémio Nobel 2016 da Medicina ao biólogo japonês Yoshinori Ohsumi. As suas descobertas nos mecanismos de autofagia apontam no sentido de que esse processo de limpeza e reciclagem celulares é essencial para prevenir doenças neurodegenerativas e outras. Os interessados poderão consultar o seguinte link: https://www.theguardian.com/science/live/2016/oct/03/nobel-prize-in-medicine-2016-to-be-announced-live.
De um modo geral, e desde os primeiros estudos em ratos pelo Dr. Clive McCay em 1935, que a restrição calórica tem sido extensivamente revista e reconhecida como uma estratégia anti-envelhecimento “potente”! Intervenções em vários tipos de espécies animais (desde invertebrados a mamíferos de maior porte como primatas) têm demonstrado que a restrição calórica (sem subnutrição) não só aumenta a esperança de vida (média e máxima), como atrasa o início das chamadas “doenças da idade” (Martin, Mattson & Maudsley, 2006; Xiang & He, 2011; Lee & Min, 2013; Kitada & Koya, 2013b; Szafranski & Mekhail, 2014; Testa et al., 2014). O regime de jejum intermitente (nada mais do que uma estratégia de restrição calórica como foi descrito na parte 1 deste artigo) parece oferecer o mesmo tipo de benefícios (Martin, Mattson, & Maudsley, 2006; Robertson & Mitchell 2013).
Ora, os mecanismos pelos quais a restrição calórica ou jejum induzem benefícios para a saúde parecem estar (em grande medida) relacionados com esta relação antagónica entre sinalização de insulina e autofagia. Está fácil de perceber, sendo a autofagia um processo catabólico (essencial, normal e protector, volto a salientar) e a activação das vias relacionadas com a sinalização a insulina um processo anabólico (igualmente importante e essencial na síntese proteica, a insulina não é a “má da fita”), quando uma das vias está activada a outra terá que estar inibida. Em termos práticos, o jejum activa a “maquinaria” da autofagia e ingerir uma refeição (sobretudo contendo proteína e/ou hidratos de carbono) activa a “maquinaria” da sinalização de insulina. O que parece ser essencial é de facto que haja períodos que permita o processo de eliminação e reciclagem proporcionado pela autofagia, e para isso acontecer é preciso não comer durante algum tempo (pelo menos 10-12 horas). Se não houver “espaço” para este processo (devido à ingestão constante de comida), isto poderá conduzir a um estado de sinalização de insulina “aberrante”, que poderá conduzir a muitas doenças normalmente associadas com um metabolismo deficiente da glucose e da insulina e que coincidem com as chamadas “doenças da idade”.
(Aviso: os menos “nerds” devem saltar o parágrafo seguinte)
Resumidamente, alguns dos mecanismos identificados em estudos com animais e que parecem estar subjacentes aos benefícios para a saúde induzidos pela restrição calórica ou jejum intermitente através regulação da sinalização das vias da autofagia e da insulina são: 1) Inibição da sinalização da via insulina/IGF-1 (devido à diminuição de aminoácidos e glucose circulantes) e das suas vias alvo protein kinase B (PKB)/mammalian target of rapamycin (mTOR); 2) Activação da via da sirtuína 1 (SIRT1), devido ao aumento no rácio de NAD+/NADH, e cujas vias alvo incluem a activação da adenosine monophosphate protein kinase (AMPK), factores de transcrição forkhead box O (FOXO), proliferator-activated receptor-gamma coactivator 1-alpha (PGC-1α) (um factor de biogénese mitocontrial), e inibição do factor de transcrição pró-inflamatório NFkB; 3) Activação da via da AMPK, devido ao aumento intracelular do rácio AMP/ATP, que por sua vez induz uma regulação positiva dos factores de transcrição FOXO e PGC-1α e inibição da via PKB/mTOR. (Martin, Mattson & Maudsley, 2006; Han & Ren 2010; Rubinsztein, Mariño & Kroemer, 2011; Yen & Klionsky, 2008; Xiang & He, 2011; Pallauf, & Rimbach, 2013; Pyo, Yoo, & Jung, 2013; Hu & Liu, 2014; Szafranski & Mekhail, 2014; Amigo & Kowaltowski, 2014; Testa, G. et al., 2014; Madeo et al., 2015).
Em humanos, apesar da menor abundância de estudos controlados e randomizados (pelos motivos referidos na parte 1 deste artigo), várias revisões de estudos de intervenção e observacionais (Yen & Klionsky, 2008; Marzetti, E. et al., 2009; Han & Ren 2010; Robertson & Mitchell, 2013; Testa et al., 2013; Madeo et al., 2015; Fan et al., 2016) indicam que os putativos benefícios para a saúde induzidos pela restrição calórica ou jejum intermitente têm por base os mesmos mecanismos relacionados com a sinalização das vias da insulina e regulação da autofagia. Alguns benefícios apontados incluem: maior longevidade saudável; melhor perfil lipídico; pressão arterial controlada; optimização da função diastólica e sistólica; melhor controlo homeostático da insulina e glucose; melhor sensibilidade à insulina e glucose; menor incidência de doenças neurodegenerativas; menor adiposidade; melhor biogénese mitocondrial no músculo esquelético; maior capacidade antioxidante; menores níveis de ROS e stress oxidativo.
* Poderá a Restrição calórica/ Jejum intermitente (CR/IF) atenuar a ocorrência de doenças da idade através da regulação da sinalização “aberrante” de insulina e autofagia?
Em conclusão, o efeito da restrição calórica ou jejum intermitente na regulação da sinalização de insulina e da autofagia parece emergir como um eixo regulatório central que merece atenção (pelo menos da minha parte).
Na terceira parte deste artigo abordarei então quais poderão ser implicações e aplicações práticas de restrição calórica ou jejum. Devemos todos fazer restrição calórica? De forma permanente e quanto? Em que fase da vida? Em que condições de saúde? Será que é na “intermitência” que estão os melhores ganhos?
Fiquem por aí!
Nuno Correia
Bibliografia e Referências
Amigo, I. & Kowaltowski, A.J., 2014. Dietary restriction in cerebral bioenergetics and redox state. Redox Biology, 2(1), pp.293–304.
Dröge W., 2009. Avoiding the First Cause of Death. New York, Bloomington. iUniverse, Inc.
Fan, J. et al., 2016. Autophagy as a Potential Target for Sarcopenia. Journal of Cellular Physiology, 231(7), pp.1450–1459. [Epub 2015 Dec 10].
Han, X. & Ren, J., 2010. Caloric restriction and heart function: is there a sensible link? Acta pharmacologica Sinica, 31(9), pp.1111–1117.
Hu, F. & Liu, F., 2014. Targeting tissue-specific metabolic signaling pathways in aging: the promise and limitations. Protein & cell, 5(1), pp.21–35.
Lavallard, V.J. et al., 2012. Autophagy, signaling and obesity. Pharmacological Research, 66(6), pp.513–525.
Lee, S.-H. & Min, K.-J., 2013. Caloric restriction and its mimetics. BMB reports, 46(4), pp.181–7.
Lee, S.-H. & Min, K.-J., 2013. Caloric restriction and its mimetics. BMB reports, 46(4), pp.181–7.
Lindeberg, S., 2010. Food and Western Disease: Health and Nutrition from an Evolutionary Perspective. Oxford, United Kingdom: Wiley-Blackwell.
Madeo, F. et al., 2015. Essential role for autophagy in life span extension. Journal of Clinical Investigation, 125(1), pp.85–93.
Martin, B., Mattson, M.P. & Maudsley, S., 2006. Caloric restriction and intermittent fasting: two potential diets for successful brain aging. Ageing research reviews, 5(3), pp.332–53.
Masoro.E. L., 2002. Caloric Restriction: A Key to Understanding and Modulating Aging. Texas, USA: ELSEVIER.
Pyo, J.O., Yoo, S.M. & Jung, Y.K., 2013. The interplay between autophagy and aging. Diabetes and Metabolism Journal, 37(5), pp.333–339.
Robertson, L.T. & Mitchell, J.R., 2013. Benefits of short-term dietary restriction in mammals. Experimental gerontology, 48(10), pp.1043–8.
Rubinsztein, D.C., Mariño, G. & Kroemer, G., 2011. Autophagy and aging. Cell, 146(5), pp.682–695.
Rubinsztein, D.C., Mariño, G. & Kroemer, G., 2011. Autophagy and aging. Cell, 146(5), pp.682–695.
Szafranski, K. & Mekhail, K., 2014. The fine line between lifespan extension and shortening in response to caloric restriction. Nucleus, 5(1), pp.56–65.
Testa, G. et al., 2014. Calorie restriction and dietary restriction mimetics: a strategy for improving healthy aging and longevity. Current pharmaceutical design, 20(18), pp.2950–77.
Xiang, L. & He, G., 2011. Caloric restriction and antiaging effects. Annals of Nutrition and Metabolism, 58(1), pp.42–48.
Yen, W.-L. & Klionsky, D.J., 2008. How to live long and prosper: autophagy, mitochondria, and aging. Physiology (Bethesda, Md.), 23(70), pp.248–262.
PODERÁ A RESTRIÇÃO CALÓRICA OU O JEJUM INTERMITENTE CONTRIBUIR PARA EVITAR “DOENÇAS DA IDADE” E VIVER MAIS TEMPO? – PARTE 1
Introdução
Neste artigo debruçar-me-ei sobre a possibilidade da restrição calórica ou jejum intermitente constituírem estratégias terapêuticas nutricionais eficazes para prevenir, amenizar ou mesmo eliminar algumas “doenças ditas da idade” e dessa forma contribuir para viver melhor e mais tempo. É importante referir que a maior parte dos estudos sobre os efeitos de restrição calórica ou jejum intermitente (ou restrição calórica intermitente) na esperança de vida são de carácter mecanicista e conduzidos em modelos animais e/ou in-vitro. É compreensível a existência duma menor abundância de estudos de intervenção em humanos nesta área. Se pensarmos um pouco, não é fácil conduzir estudos em humanos sujeitos a restrição calórica para estudar os seus efeitos na esperança de vida e na incidência de “doenças da idade”. Não só não será fácil recrutar pessoas para voluntariamente incorrerem num período de restrição calórica, tal como não é prático estudar em humanos (de forma randomizada e controlada) os efeitos da restrição calórica ou jejum na esperança de vida, porque simplesmente estes “vivem muito tempo”. Por forma a obter resultados em tempo útil torna-se essencial conduzir estudos em espécies com esperança de vida mais curta. Contudo, estudos observacionais e alguns estudos de intervenção em humanos (discutidos mais à frente) parecem confirmar os mesmos efeitos benéficos para a saúde e pelos mesmos mecanismos moleculares daqueles observados em animais.
De referir ainda que, no contexto experimental, restrição calórica é definida como “redução da ingestão de alimento sem subnutrição”. Ou seja, normalmente intervenções nutricionais que implicam uma redução de 10-40% das necessidades calóricas diárias em que apenas as calorias e não os nutrientes são restringidos (na maior parte dos estudos controlados este aspecto é assegurado com suplementação de vitaminas e minerais) (Kitada & Koya, 2013b; Robertson & Mitchell, 2013). Esta noção é importante! Défice calórico não implica défice de nutrientes e excesso calórico não implica que as necessidades de nutrientes estão colmatadas. Jejum intermitente não será mais do que um método alternativo de restrição calórica em que a ingestão de comida é restringida durante um determinado período de tempo (normalmente entre 16 a 24 horas) seguido de um período de ingestão sem restrição, e que tem sido apontado como produzindo efeitos benéficos na saúde similares a protocolos de restrição calórica mais constante (Martin, Mattson, & Maudsley, 2006; Robertson & Mitchell 2013).
Parte 1
Deveremos aceitar ser “doentes” só porque envelhecemos?
É recorrente ouvir-se dizer que a doença é algo que “vem com o pacote da idade”. De facto envelhecer é uma chatice! A percepção geral de um declínio progressivo de todas as nossas funcionalidades à medida que envelhecemos não é, infelizmente, uma ilusão. Existem várias teorias sobre o envelhecimento. Embora seja um tema certamente muito interessante, uma descrição detalhada das várias teorias do envelhecimento não é o objectivo deste artigo. Duma forma geral, são apontados como principais os seguintes mecanismos subjacentes ao processo de envelhecimento:
- A teoria da Metilação do DNA, redução do comprimento dos Telómeros e o “limite de Hayflick”. O “limite de Hayflick” (fenómeno descoberto por Leonard Hayflick) determina que as células humanas têm um número limite de replicação, depois do qual elas tornam-se senescentes. Os telómeros (i.e. uma espécie de “capacetes” protectores no final de cada cromossoma) tornam-se progressivamente mais curtos a cada divisão celular (Shay & Wright 2000). Ora, a metilação do DNA (um processo essencial e reparador que consiste na adição de grupos de metil ao DNA e que pode ser promovida pela abundância de doadores de metil provenientes da dieta por exemplo) é apontada como sendo protectora do comprimento dos telómeros e dessa forma adiar a morte celular e o envelhecimento. Por exemplo, em modelos animais, a hipometilação da enzima telomerase reverse trancriptase conduziu à preservação do comprimento dos telómeros dos leucócitos (Zhang et al. 2003; 2014). Neste exemplo, é plausível inferir que adiar a senescência dos leucócitos (através de metilação e consequente conservação do comprimento dos telómeros) pode contribuir para uma maior robustez do sistema imunitário e dessa forma influenciar positivamente a longevidade.
- A teoria do envelhecimento associada à Inflamação crónica. Esta teoria sugere que inflamação crónica não resolvida induz o organismo humano a não alocar recursos para o funcionamento de outras funções normais (pois estão permanentemente alocados para a inflamação que não se resolve) e dessa forma conduz a um envelhecimento precoce de vários orgãos e tecidos, e a instalação precoce de “doenças da idade”.
- A teoria do stress oxidativo e dos radicais livres. Esta teoria, originalmente proposta pelo Dr. Denham Harman em 1956, é baseada na premissa de que o processo de envelhecimento é mediado por danos causados por radicais livres. Teoricamente, reduzindo a acumulação de radicais livres (e.g. espécies reactivas de oxigénio) e ao mesmo tempo aumentando a capacidade antioxidante do organismo (aumentando glutationa e enzimas antioxidantes como superóxido dismutase e catalase), poder-se-á prevenir danos aos tecidos (desacelerando o processo de envelhecimento) e prevenir a ocorrência de “doenças da idade”, e consequentemente contribuir para aumentar a longevidade funcional (Harman, 1988; 2006).
Muito bem, envelhecer é inevitável! Já sabemos disso. Contudo, se pensarmos um pouco, todos os mecanismos apontados têm uma raíz ambiental, ou seja, podemos até certo ponto controlá-los através de decisões que tomamos todos os dias. Nomeadamente decisões sobre o que comemos e como nos mexemos. E isto são boas notícias! Está de facto nas nossas mãos desacelerar o processo de senescência e prevenir a instalação das chamadas “doenças da idade”. Note-se que se para nós (mundo ocidental) é estatisticamente “normal” envelhecer com diabetes, hipertensão, cancro, demência, sarcopenia, osteoporose, doenças cardiovasculares, resistência à insulina, obesidade e inflamação crónica (porque a população estudada tem um estilo de vida que conduz à doença), noutras populações contemporâneas (não ocidentalizadas) essas doenças são raras ou mesmo inexistentes. Neste âmbito, convido o leitor a consultar aquele que considero um dos melhores livros que conheço sobre nutrição e estilo de vida, e a sua relação com a incidência das chamadas doenças “ocidentais”, Food and Western Disease: Health and Nutrition from an Evolutionary Perspective de Staffan Lindeberg. De facto, se queremos apontar para o nosso máximo potencial de saúde e de vida, não devemos olhar apenas para o que é “normal” numa determinada população, porque essa pode ser uma população doente. Devemos sim procurar o que é “biologicamente normal” para um ser humano! Uma espécie que está desenhada (em termos evolutivos) para lidar com uma série de estímulos ambientais que incluem certos níveis de actividade física, nutrição, exposição solar e sono. E se por um lado envelhecer é normal, não parece ser “biologicamente normal” envelhecer com as doenças crónicas.
Neste contexto, é igualmente frequentemente citado o Okinawa Centenarian Study. A população de Okinawa apresenta o maior rácio de centenários (saudáveis) do planeta (50/100.000 vs 10-20/100.000 nos USA) e como tal do maior interesse para estudar os factores que potenciam essa longevidade. Um dos factores identificados (para além dum nível apreciável de actividade física e interação social) foi o facto das populações acima dos 70 anos ingerirem cerca de 11% de calorias abaixo (aproximadamente 1785kcal/dia o que constitui uma restrição calórica muito moderada) do que seria recomendado para manutenção do seu peso corporal (de acordo com a equação Harris-Benedict), contudo numa dieta rica em nutrientes (Wilcox et al., 2006).
 * Os habitantes de Okinawa deverão ter o rácio mais elevado de centenários em todo o mundo com 50/100.000.
* Os habitantes de Okinawa deverão ter o rácio mais elevado de centenários em todo o mundo com 50/100.000.
O que podemos fazer para viver mais tempo e melhor é a minha principal motivação intrínseca. Como referi, as nossas escolhas em relação ao tipo de exercício físico, alimentos que ingerimos e outros factores relacionados com o estilo de vida podem condicionar quanto tempo vivemos e (porventura mais importante) quão saudáveis e funcionais vivemos. Na segunda parte deste artigo, abordarei alguns mecanismos pelos quais as intervenções nutricionais como a restrição calórica ou o jejum intermitente podem conduzir a benefícios para a saúde. E na terceira parte, abordarei possíveis implicações e aplicações práticas da prática de restrição calórica ou jejum, bem como quais as populações que podem beneficiar mais dessas estratégias nutricionais e as que as devem evitar.
Fiquem por aí!
Nuno Correia
Bibliografia e Referências
Dröge W., 2009. Avoiding the First Cause of Death. New York, Bloomington. iUniverse, Inc.
Harman D., 1988. Free radicals in aging. Mol Cell Biochem. Dec; 84(2), pp.155-161.
Harman D., 2006. Free radical theory of aging: an update: increasing the functional life span. Ann N Y Acad Sci. May;1067, pp.10-21.
Kitada, M. & Koya, D., 2013b. SIRT1 in Type 2 Diabetes: Mechanisms and Therapeutic Potential. Diabetes & metabolism journal, 37(5), pp.315–25.
Lindeberg, S., 2010. Food and Western Disease: Health and Nutrition from an Evolutionary Perspective. Oxford, United Kingdom: Wiley-Blackwell.
Martin, B., Mattson, M.P. & Maudsley, S., 2006. Caloric restriction and intermittent fasting: two potential diets for successful brain aging. Ageing research reviews, 5(3), pp.332–53.
Masoro.E. L., 2002. Caloric Restriction: A Key to Understanding and Modulating Aging. Texas, USA: ELSEVIER.
Robertson, L.T. & Mitchell, J.R., 2013. Benefits of short-term dietary restriction in mammals. Experimental gerontology, 48(10), pp.1043–8.
Shay J.W., Wright W.E. 2000. Hayflick, his limit, and cellular ageing. Nat Rev Mol Cell Biol. Oct;1(1), pp.72-76.
Zhang D. et al., 2013. Homocysteine-related hTERT DNA demethylation contributes to shortened leukocyte telomere length in atherosclerosis. Atherosclerosis. Nov; 231(1), pp.173-179.
Zhang D.H., Wen X.M., Zhang L. & Cui W., 2014. DNA methylation of human telomerase reverse transcriptase associated with leukocyte telomere length shortening in hyperhomocysteinemia-type hypertension in humans and in a rat model. Circ J. 78(8), pp.1915-1923.
Wilcox D.C. et al., 2006. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology 7, pp.173–177.














